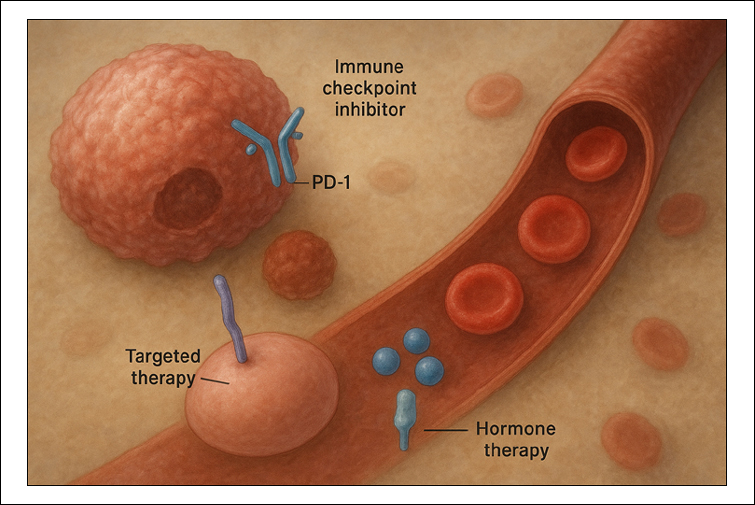
 항암제 크게 두 단계로 분류될 수 있다.
항암제 크게 두 단계로 분류될 수 있다.제1단계는 작용 부위(site of action)로서 종양세포(tumor cell)의 핵/세포질/막, 종양 혈관(endothelium), 면역계(immune system), 내분비계(endocrine system) 등을 기준으로 하며, 제2단계는 작용 메커니즘(mechanism of action)으로서 표적 단백질(target), 세포내 경로(pathway), 항체, 면역 조절, 유전자 변형 등 구체적 표적/기전을 중심으로 한다. 이 기준에 의해 고전적 화학요법(chemotherapy), 호르몬요법(hormonal therapy), 표적치료(targeted therapy), 면역치료(immunotherapy), 항체약물접합체(immunoconjugates), 기타 등이 모두 통합돼 정리될 수 있다.
| 작용별 대표 약물들과 특징 |
|---|
|
1. 알킬화제 (Alkylating Agents) 🔹 대표 약물: • 사이클로포스파마이드(Cyclophosphamide): 백혈병, 림프종, 유방암, 난소암 등. • 시스플라틴(Cisplatin): 고환암, 난소암, 폐암, 방광암 등, • 카보플라틴(Carboplatin): 시스플라틴과 유사, 독성이 덜함. • 테모졸로마이드(Temozolomide): 뇌종양(교모세포종 등)에 사용 🔹 작용 메커니즘: DNA에 알킬기를 결합시켜 DNA 복제 및 전사를 방해, 세포 사멸 유도 🔹 작용 부위: DNA (세포 주기 비특이적. 모든 단계에서 작용, 특히 구아닌의 N7 위치): 세포핵 내에서 DNA 구조를 직접 변형 🔹 특징: • 세포 주기 전 단계에서 작용하므로 빠르게 분열하는 암세포뿐만 아니라 느린 세포에도 효과적. • 광범위한 암(백혈병, 림프종, 고형암 등)에 사용. ⚠️ 유의사항: - 독성: 신장 독성(시스플라틴), 골수 억제, 오심. - 장기 사용 시 이차성 암(백혈병) 위험. - 충분한 수분 섭취 필요(시스플라틴 신장 보호). |
|
2. 대사길항제 (Antimetabolites) 🔹 대표 약물: 메토트렉세이트(Methotrexate), 5-플루오로우라실(5-FU) 🔹 작용 메커니즘: DNA/RNA 합성에 필요한 대사 과정을 차단. • 메토트렉세이트: 엽산 대사 억제(DHFR 억제). • 5-FU: 티미딜레이트 합성 억제. 🔹 작용 부위: DNA/RNA 합성 단계(S기 특이적). 🔹 특징: • 백혈병, 유방암, 대장암 등에 사용. • 메토트렉세이트는 고용량 시 류코보린(Leucovorin) 병용으로 독성 완화. ⚠️ 유의사항: • 부작용: 골수 억제, 구내염, 간 독성. • 신장 기능 모니터링(메토트렉세이트 배설 지연 시 독성 증가). 🚫 약물 상호작용: • NSAID, 프로베네시드 등은 MTX 배설을 감소시켜 독성 증가. • 엽산 과다 복용은 저용량 MTX의 효능(류마티스 관절염 등)을 저하시킬 수 있음. |
|
3. 항암항생제 (Antitumor Antibiotics) 🔹 대표 약물: 독소루비신(Doxorubicin), 블레오마이신(Bleomycin) 🔹 작용 메커니즘: • 독소루비신: DNA 삽입 및 토포이소머라제 II 억제, DNA 복제 방해. • 블레오마이신: DNA 사슬 절단. 🔹 작용 부위: DNA 및 세포 분열 과정. 🔹 특징: • 림프종, 유방암, 폐암 등에 사용. • 독소루비신은 안트라사이클린 계열로 강력한 항암 효과. • 에피루비신(Epirubicin): 유방암, 위암(독소루비신과 유사, 독성 낮음. • 미토마이신-C(Mitomycin-C): 위암, 췌장암, 방광암. ⚠️ 유의사항: • 독소루비신: 심장 독성(누적 용량 제한), 골수 억제. • 블레오마이신: 폐 섬유증 위험, 산소 요법 주의. 🚫 약물 상호작용: • 독소루비신: 심장 독성 약물(예: 트라스투주맙) 병용 주의. • 블레오마이신: 산소 요법, 방사선 치료 병용 시 폐 독성 증가. |
|
4. 토포이소머라제 억제제 (Topoisomerase Inhibitors) 🔹 대표 약물: ① Topoisomerase I 억제제 • Irinotecan (이리노테칸): 대장암, 폐암 등에 사용. • Topotecan (토포테칸): 난소암, 소세포폐암 치료에 주로 사용. ② Topoisomerase II 억제제 • Etoposide (에토포사이드): 폐암, 고환암, 림프종 등에 사용. • Doxorubicin (독소루비신): 유방암, 백혈병, 림프종 등 다양한 암에 적용. • Daunorubicin (다우노루비신): 급성 백혈병 치료에 사용. 🔹 작용 메커니즘: DNA 풀림 과정(토포이소머라제) 억제, DNA 복제/전사 방해. 🔹 작용 부위: DNA 복제 및 전사 과정. ⚠️ 유의사항: • 부작용: 설사(이리노테칸), 골수 억제. • 이리노테칸은 UGT1A1 유전자 변이 시 독성 증가 주의. |
|
5. 유사분열 억제제 (Mitotic Inhibitors) 🔹 대표 약물: ① Taxanes (택산류): • Paclitaxel (파클리탁셀): 유방암, 난소암, 비소세포폐암 등에 사용. • Docetaxel (도세탁셀): 유방암, 전립선암, 위암 등에 적용. ② Vinca Alkaloids (빈카 알칼로이드): • Vincristine (빈크리스틴): 급성 백혈병, 림프종, 소아암 등에 사용. • Vinblastine (빈블라스틴): 호지킨 림프종, 고환암 등에 사용. • Vinorelbine (비노렐빈): 비소세포폐암, 유방암 등에 적용. 🔹 작용 메커니즘: 미세소관 형성 억제, 세포 분열(M기) 중지. 🔹 작용 부위: 세포 분열의 미세소관. ⚠️ 유의사항: • 빈크리스틴: 신경독성(말초신경병증). • 파클리탁셀: 과민 반응(사전 약물 투여 필요), 골수 억제. |
|
6. 표적치료제 (Targeted Therapies) 🔹 대표 약물: ① Tyrosine Kinase 억제제 (TKIs): • BCR-ABL 티로신 키나제 억제제(TKI): 이매티닙(Imatinib) - 만성골수성백혈병(CML), 위장관기질종양(GIST) 치료에 사용 (BCR-ABL, c-KIT 표적). - BCR-ABL, c-KIT, PDGFR 티로신 키나제를 선택적으로 억제하여 암세포의 성장 신호 차단. - 필라델피아 염색체 양성 만성골수성백혈병(CML, 만성기, 가속기, 급성기) 치료에 사용. - c-KIT(CD117) 양성 위장관기질종양(GIST) 치료에 사용. - 기타: Ph+ 급성림프구성백혈병(ALL), 골수형성이상증후군(MDS/MPD), 호염구증대증후군(HES) 치료에 사용. - 장기 사용 시 ABL 키나제 도메인 돌연변이(예: T315I)로 내성 발생 가능. - 내성 시 2세대 TKI(다사티닙, 닐로티닙) 또는 3세대 TKI(포나티닙)로 전환 고려. - T315I 돌연변이에는 포나티닙 또는 아시미니브(Scemblix)가 효과적. • Erlotinib (얼로티닙), Gefitinib (게피티닙): 비소세포폐암 (EGFR 변이 표적). • Sunitinib (수니티닙): 신장세포암, GIST (VEGFR, PDGFR 표적). • ALK(Anaplastic Lymphoma Kinase) 억제제: - 알렉티닙(Alectinib), 크리조티닙(Crizotinib): 양성 비소세포폐암(NSCLC)을 주로 치료하는 표적치료제 • EGFR(상피세포 성장인자 수용체) 억제제: 오시머티닙(Osimertinib) - 돌연변이가 있는 비소세포폐암(NSCLC)을 치료하는 3세대 티로신 키나제 억제제(TKI) - 1세대(게피티닙, 얼로티닙) 및 2세대(아파티닙) TKI에 비해 T790M 내성 돌연변이에 효과적. - 뇌전이 환자에게 우수한 효능 (혈뇌장벽 투과성 높음). - 1차 치료로 사용 시 무진행 생존기간(PFS) 연장 효과 입증 (FLAURA 연구). - 장기 사용 시 C797S 돌연변이 등 새로운 내성 발생 가능. - 내성 발생 시 4세대 EGFR TKI 또는 다른 표적치료제(예: MET 억제제)로 전환 고려. - EGFR 돌연변이 양성 전이성 NSCLC의 1차 치료. - EGFR T790M 돌연변이 양성 NSCLC (1세대/2세대 TKI 치료 후 진행 시). - EGFR 돌연변이 양성 NSCLC의 수술 후 보조 요법 (절제 후). ② Monoclonal Antibodies (단클론 항체): • Trastuzumab (트라스투주맙): HER2 양성 유방암, 위암 치료. • Rituximab (리툭시맙): CD20 양성 비호지킨 림프종, 만성림프구성백혈병. • Cetuximab (세툭시맙): 대장암, 두경부암 (EGFR 표적). ③ PARP 억제제: • Olaparib (올라파니브): BRCA 변이 양성 난소암, 유방암 치료. • Rucaparib (루카파니브): BRCA 변이 관련 암. ④ mTOR 억제제: • Everolimus (에베롤리무스): 신장세포암, 유방암, 신경내분비종양. ⑤ BRAF/MEK 억제제: • Vemurafenib (베무라페닙), Dabrafenib (다브라페닙): BRAF V600E 변이 흑색종. 🔹 작용 메커니즘: - 알렉티닙: ALK 단백질 인산화 억제, 암세포 성장 억제. - 오시머티닙: EGFR 돌연변이 억제. - 이매티닙: BCR-ABL 융합 단백질 억제. 🔹 작용 부위: 특정 신호전달 경로(예: ALK, EGFR, BCR-ABL). 🔹 특징: - 알렉티닙: ALK 양성 NSCLC(1차 또는 크리조티닙 후), 보조 요법. - 오시머티닙: EGFR T790M 돌연변이 NSCLC. - 이매티닙: 만성골수성백혈병(CML), GIST. ⚠️ 유의사항: - 알렉티닙: 간 독성, 서맥, 광과민성, 폐 독성 주의. - 오시머티닙: 심전도 이상(QT 연장) 모니터링. - 이매티닙: 체액 저류, 간 독성. ⑥ CDK4/6 억제제(Cyclin-Dependent Kinase 4/6 inhibitor): 🔹 대표약물: • 리보시클립(Ribociclib, Kisqali): - 호르몬 수용체 양성(HR+), HER2 음성(HER2-) 유방암 치료에 주로 사용 - NATALEE 시험에서 사용. 400mg/일(3주 투여, 1주 휴약). • 팔보시클립(Palbociclib, Ibrance): - 전이성 유방암(PALOMA 시험)에서 입증. • 아베마시클립(Abemaciclib, Verzenio): - 조기 유방암(MonarchE 시험)에서 사용. 🔹 작용 기전: - 세포 주기 조절에 관여하는 CDK4와 CDK6 단백질을 선택적으로 억제하여 Rb(Retinoblastoma protein) 인산화를 막아 Rb를 활성화된 상태로 유지하면 세포 주기가 G1 단계에서 정지되어 암세포 증식이 억제됨. - 종양억제단백질이면서 세포주기를 조절하는 Rb가 결손 시 효과가 감소. 🔹 임상 적용: 전이성 유방암(MBC)뿐만 아니라, NATALEE 시험처럼 조기 유방암(EBC, Stage II-III)에서 보조 요법으로 확대. ⚠️ 주의사항 및 특징: - Palbociclib (Ibrance): 호중구감소증 ↑↑, 간질성 폐질환 및/또는 폐렴, 가장 심한 골수억제, 설사는 적음. - Ribociclib (Kisqali): 호중구감소증, 간효소 상승 QT 연장, 간독성 주의. 간질성 폐질환. - Abemaciclib (Verzenio): 설사 ↑↑, 피로, ALT/AST 상승, 간질성 폐질환, 설사 빈도 높고, 지속 투여(연속형) 가능. 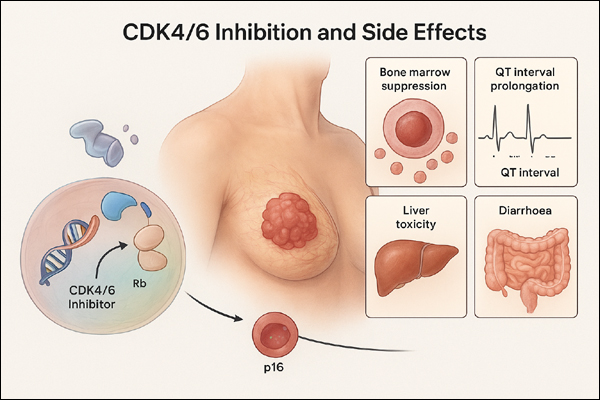 |
|
7. 면역항암제 (Immunotherapy) ① 면역관문억제제 (Immune Checkpoint Inhibitors) - 암세포가 면역 반응을 억제하는 경로(예: PD-1/PD-L1, CTLA-4)를 차단하여 T세포의 항암 활성을 증진. 🔹 대표 약물: • PD-1 억제제: - Nivolumab (니볼루맙, Opdivo): 비소세포폐암, 흑색종, 신장세포암, 간세포암 등. - Pembrolizumab (펨브롤리주맙, Keytruda): 흑색종, 비소세포폐암, 두경부암, MSI-H/dMMR 암. - Tislelizumab(테슬렐리주맙, Tevimbra inj.): PD-1 차단(T세포 표면의 PD-1을 결합하여 PD-L1/PD-L2와의 상호작용을 막음), 면역 활성화(사이토카인 생산을 촉진하고, 항종양 면역 반응을 유발), 정맥 주사(IV)(보통 3주마다 1회). • PD-L1 억제제:Atezolizumab (아테졸리주맙, Tecentriq): 비소세포폐암, 방광암, 유방암. - Durvalumab (두르발루맙, Imfinzi): 비소세포폐암, 소세포폐암. • CTLA-4 억제제: - Ipilimumab (이필리무맙, Yervoy): 흑색종, 신장세포암 (니볼루맙과 병용). 🔹 적응증: 다양한 고형암 및 혈액암에서 사용, 특히 MSI-H(고빈도 미소부위불안정성) 또는 TMB-H(종양 돌연변이 부담 높음) 암에 효과적. ② CAR-T 세포 요법 (Chimeric Antigen Receptor T-cell Therapy) - 환자의 T세포를 채취해 유전자 조작으로 특정 암 항원을 인식하도록 만든 후 주입. 🔹 대표 약물: - Tisagenlecleucel (Kymriah): B세포 급성림프구성백혈병(ALL), 미만성 대세포 B세포 림프종(DLBCL). - Axicabtagene ciloleucel (Yescarta): DLBCL, 여포성 림프종. 🔹 적응증: 주로 재발/불응성 혈액암(백혈병, 림프종)에 사용. 🔹 특징: 맞춤형 치료, 높은 비용, 사이토카인 방출 증후군(CRS) 및 신경독성 관리 필요. ③ 사이토카인 요법 - 면역 활성을 높이는 사이토카인(예: 인터루킨, 인터페론) 사용. 🔹 대표 약물: - Interleukin-2 (IL-2, Aldesleukin): 전이성 신장세포암, 흑색종. - Interferon-alpha: 만성골수성백혈병, 모발세포백혈병, 흑색종. 🔹 특징: 부작용(독감 유사 증상, 피로)으로 사용 빈도 감소. ④ 암 백신 - 암세포 항원을 이용해 면역 반응 유도. 🔹 대표 약물: - Sipuleucel-T (Provenge): 전이성 전립선암. 🔹 특징: 현재 제한된 적응증, 연구 단계의 백신 다수. ⑤ 면역조절제 - 면역 체계의 전반적인 활성을 조절. 🔹 대표 약물: - Lenalidomide (레날리도마이드, Revlimid): 다발성 골수종, 림프종. - Thalidomide (탈리도마이드): 다발성 골수종. ⚠️ 유의사항: 🔹 면역관문억제제: - 면역 관련 부작용(irAE) - 피부 발진, 간염, 폐렴, 대장염, 내분비 이상(갑상선, 부신). 🔹 CAR-T 요법: - 사이토카인 방출 증후군(CRS, 고열, 저혈압), 신경독성, 감염 위험. 🔹 사이토카인 요법: 독감 유사 증상, 피로, 간독성. 🔹 관리: - 부작용 조기 발견을 위해 정기 모니터링, 스테로이드 또는 면역억제제 사용 가능. ⑥ Oncolytic Virus - 암세포를 선택적으로 감염시켜 파괴하는 바이러스를 이용한 암 치료 방식. 🔹 T-VEC (Talimogene Laherparepvec, 임리직): • 작용 기전: - 직접적 암세포 용해: T-VEC는 흑색종 세포에 감염되어 복제 후 세포를 파괴(용해). - 면역 활성화: 파괴된 암세포에서 방출된 항원과 GM-CSF(Granulocyte-Macrophage Colony-Stimulating Factor)가 면역계(특히 T세포)를 자극해 전신적 항암 면역 반응 유도. - 국소 및 전신 효과: 주사 부위(국소)뿐만 아니라 멀리 떨어진 전이성 병변에도 효과. - 암젠(Amgen)社 개발. 피하 주사로 투여. - T-VEC는 유전자 변형 단순포진바이러스(HSV-1) 기반의 항암바이러스로, 암세포를 선택적으로 감염 및 파괴하고, GM-CSF 유전자 삽입을 통해 면역 반응을 활성화. - 바이러스는 GM-CSF 유전자를 삽입해 면역 활성화를 강화하며, 바이러스의 병원성은 약화시켜 정상 세포에 대한 영향을 최소화. - 2015년 FDA 승인을 받아 진행성 흑색종(절제 불가능한 3B-4기) 치료제로 사용 중. • 임상 결과 (흑색종 중심)OPTiM 3상 시험: - T-VEC 투여군의 지속적 반응률(DRR): 16.3% (대조군 2.1%). - 전체 생존율(OS): T-VEC군 23.3개월 vs. 대조군 18.9개월 (통계적 유의성 미약). - 부작용: 주로 경증(발열, 피로, 주사 부위 반응 등). • 병용 요법: - T-VEC와 면역관문억제제(예: 항-PD-1, 항-CTLA-4)의 병용이 시너지 효과를 보임. - 예: T-VEC + 이필리무맙 병용 시 객관적 반응률(ORR) 39% (단독 대비 개선). |
|
8. 호르몬 요법 (Hormonal Therapy) ① 유방암 관련 호르몬 요법 🔹 에스트로겐 수용체(ER) 억제제: • Tamoxifen (타목시펜): - 작용: 선택적 에스트로겐 수용체 조절제(SERM)로, 유방 조직에서 에스트로겐 작용을 차단. - 적응증: ER 양성 유방암(전이성 또는 조기), 예방 요법(고위험군). - 투여: 경구, 20mg 1일 1회, 5~10년(보조 요법 시). - 부작용: 안면 홍조, 자궁내막암 위험 증가, 혈전증, 골다공증 위험(폐경 전 여성). • Fulvestrant (풀베스트란트, Faslodex): - 작용: 선택적 에스트로겐 수용체 분해제(SERD)로, ER을 완전히 비활성화. - 적응증: 전이성 ER 양성 유방암, 타목시펜 내성 시. - 투여: 근육 주사, 500mg (1일, 15일, 이후 매달). - 부작용: 주사 부위 통증, 안면 홍조, 메스꺼움, 간효소 상승. 🔹 아로마타제 억제제 (Aromatase Inhibitors): • Anastrozole (아나스트로졸), Letrozole (레트로졸), Exemestane (엑세메스테인): - 작용: 에스트로겐 합성을 억제(아로마타제 효소 차단), 폐경 후 여성에 주로 사용. - 적응증: ER 양성 유방암(조기 또는 전이성), 보조 요법. - 투여: 경구, 1mg(아나스트로졸, 레트로졸) 또는 25mg(엑세메스테인) 1일 1회. - 부작용: 골다공증, 관절통, 안면 홍조, 피로. 🔹 기타: CDK4/6 억제제(예: Palbociclib, Ribociclib)와 병용하여 효과 증대. ② 전립선암 관련 호르몬 요법 🔹 안드로겐 박탈 요법 (Androgen Deprivation Therapy, ADT): • LHRH 작용제 (GnRH 아고니스트): - Leuprolide (루프로라이드), Goserelin (고세렐린): 👉 작용: 뇌하수체에서 LH/FSH 분비를 억제하여 테스토스테론 생성 감소. 👉적응증: 전이성 또는 진행성 전립선암, 보조 요법. 👉투여: 피하/근육 주사, 1~6개월 간격. 👉부작용: 안면 홍조, 성욕 감소, 발기부전, 골다공증, 근육량 감소. • LHRH 길항제 (GnRH 안타고니스트): - Degarelix (데가렐릭스): 👉 작용: 테스토스테론 즉각 억제, LHRH 작용제보다 빠른 효과. 👉 투여: 피하 주사, 초기 240mg, 유지 80mg/월. 👉 부작용: 주사 부위 반응, 안면 홍조, 간효소 상승. • 항안드로겐제 (Anti-androgens): - Bicalutamide (비칼루타마이드), Flutamide (플루타마이드): 👉 작용: 안드로겐 수용체(AR)를 차단하여 테스토스테론 작용 억제. 👉 적응증: 전이성 전립선암, LHRH 작용제와 병용(CAB, 완전 안드로겐 차단). 👉 투여: 경구, 비칼루타마이드 50mg 1일 1회. 👉 부작용: 간독성, 유방통, 설사. • 2세대 항안드로겐제: - Enzalutamide (엔잘루타마이드), Apalutamide (아팔루타마이드): 👉 작용: 더 강력한 AR 억제, 내성 돌연변이에도 효과. 👉 적응증: 거세저항성 전립선암(CRPC), 비전이성/전이성. 👉 부작용: 피로, 고혈압, 발작(드물게). ③ 기타 호르몬 요법 🔹 프로게스틴: 메게스트롤 아세테이트(Megestrol acetate) - 자궁내막암, 유방암(드물게). 🔹 글루코코르티코이드: 프레드니손(Prednisone) - 전립선암에서 항안드로겐제와 병용. 🔹 부신 억제제: Abiraterone (아비라테론, Zytiga) - 부신에서 안드로겐 합성 억제, 전립선암 치료. ⚠️ 유의사항: - 타목시펜: 자궁내막암, 혈전 위험. - 아나스트로졸: 골다공증 위험, 뼈 건강 모니터링. |
|
⚠️ 일반적인 유의사항 - 개인화된 치료: 항암제는 암 종류, 병기, 환자 상태에 따라 선택되며, 유전자 검사로 적합성 판단(예: ALK, EGFR 돌연변이). - 부작용 관리: 대부분의 항암제는 골수 억제, 오심, 탈모 등을 유발할 수 있으므로 정기적인 혈액검사와 모니터링 필수. - 약물 상호작용: CYP3A4 관련 약물(알렉티닙 포함) 사용 시 주의. - 임신/수유: 대부분의 항암제는 태아에 해로우므로 피임 필수. |
알킬화제(Alkylating Agents)는 DNA에 알킬기를 결합시켜 암세포의 DNA 복제와 전사를 방해함으로써 세포 사멸을 유도하는 약물이다. 세포 주기 비특이적이라 모든 세포 주기 단계에서 작용하며, 다양한 암 치료에 사용된다.
광범위한 항암 효과를 나타내며, 백혈병, 림프종, 고형암(유방암, 폐암, 난소암 등)에 주로 사용한다. 조합 요법으로 다른 항암제(예: 대사길항제, 항암항생제)와 병용해 시너지 효과를 나타낼 수 있다. 대표적으로 시스플라틴은 플래티넘 기반 약물로 강력한 항암 효과가 있으며 특히 고환암에서 완치율 높다. 테모졸로마이드는 혈액뇌장벽 통과가 가능하여 뇌종양 치료에 적합하며, MGMT 유전자 메틸화 상태에 따라 테모졸로마이드 효과 달라질 수 있다(뇌종양).
알킬화제는 강력하지만 독성이 높아 정기적인 혈액검사와 신장/간 기능 모니터링이 필수적이다.
대사길항제(Antimetabolites)는 암세포의 DNA 또는 RNA 합성에 필요한 대사 과정을 방해하여 세포 분열을 억제하고 암세포 사멸을 유도한다. 주로 세포 주기의 S기(DNA 합성 단계)에 특이적으로 작용한다.
대표적인 약물로는 메토트렉세이트(Methotrexate: 백혈병, 림프종, 유방암, 골육종), 5-플루오로우라실(5-Fluorouracil, 5-FU: 대장암, 유방암, 위암), 카페시타빈(Capecitabine: 5-FU의 전구체, 경구용, 대장암, 유방암), 젬시타빈(Gemcitabine: 췌장암, 폐암, 난소암) 등이 있다.
한편, 메토트렉세이트는 엽산 대사를 차단하므로, 암세포뿐만 아니라 정상 세포(특히 골수, 점막 세포)에도 영향을 미쳐 독성(골수 억제, 구내염 등)을 유발할 수 있으므로 엽산 또는 그 유도체(류코보린, Leucovorin)이 메토트렉세이트의 독성을 완화하기 위해 사용된다. 고용량 메토트렉세이트(예: 골육종, ALL 치료) 투여 후, 정상 세포의 손상을 줄이기 위해 류코보린(활성 엽산 유도체)을 투여하며, 류코보린은 DHFR 억제를 우회하여 THF를 직접 공급, 정상 세포의 DNA 합성을 회복시킨다. 암세포는 일반적으로 류코보린을 덜 흡수하므로 항암 효과는 유지된다. 투여 시기는 메토트렉세이트 투여 후 24~36시간 이내 시작(혈중 MTX 농도 모니터링)하며 너무 일찍 투여 시 항암 효과가 감소될 수 있다.
항암항생제(Antitumor Antibiotics)는 항생제에서 유래한 항암제로, 암세포의 DNA 또는 DNA 관련 효소를 표적으로 삼아 세포 분열을 억제하거나 DNA 손상을 유도하여 암세포 사멸을 촉진한다. 주로 세포 주기 비특이적이거나 특정 단계에서 작용하며, 다양한 암 치료에 사용된다. 빠르게 분열하는 암세포를 사멸하는 작용이 있으며, 정상 세포에도 영향을 미친다.
Topoisomerase 억제제는 항암제 중 DNA 복제와 수선 과정에서 필수적인 Topoisomerase 효소를 억제하여 암세포의 증식을 막는 약물이다. 이 약물들은 DNA의 구조적 변화를 방해하여 암세포의 분열을 억제하지만, 부작용으로 골수억제, 구토, 탈모 등이 있을 수 있다.
유사분열 억제제(Mitotic inhibitors)는 세포 분열(유사분열) 과정을 방해하여 암세포의 증식을 억제하는 항암제이다. 주로 미세소관(microtubule) 형성이나 기능을 방해하여 세포 분열을 차단한다. 이 약물들은 미세소관의 중합 또는 해중합을 방해하여 유사분열 중 염색체 분리를 막아 암세포 사멸을 유도한다. 부작용은 골수억제, 말초신경병증, 탈모, 구토 등이 흔하며, 약물에 따라 부작용 정도가 다르다.
표적치료제는 암세포의 특정 분자나 경로를 표적으로 삼아 선택적으로 공격하는 항암제이다. 정상 세포에 대한 손상을 최소화하며, 특정 암의 유전자 변이 또는 단백질 과발현에 따라 사용된다.
알렉티닙(Alectinib)과 크리조티닙(Crizotinib)은 둘 다 ALK(Anaplastic Lymphoma Kinase) 양성 비소세포폐암(NSCLC)을 주로 치료하는 표적치료제이다. 이들은 티로신 키나제 억제제(TKI)로, ALK 융합 유전자를 가진 암세포의 신호전달을 차단하여 세포 증식을 억제함다. 크리조티닙은 1세대 ALK 억제제로, 알렉티닙은 2세대 약물로 크리조티닙 내성 후 대체 치료로 사용되며, 뇌전이에 대한 효과가 우수하다.
오시머티닙(Osimertinib, 상표명: Tagrisso)은 EGFR(상피세포 성장인자 수용체) 돌연변이가 있는 비소세포폐암(NSCLC)을 치료하는 3세대 티로신 키나제 억제제(TKI)이다. 특히 EGFR T790M 내성 돌연변이 및 감작 돌연변이(예: exon 19 결실, L858R)에 효과적이며, 뇌전이 치료에 우수한 혈뇌장벽 투과성을 보인다. 오시머티닙은 EGFR 돌연변이 확인(조직 또는 액체 생검) 후 사용되며, 부작용 관리와 약물 상호작용 주의가 중요하다.
이매티닙(Imatinib, 상표명: Gleevec/Glivec)은 BCR-ABL 티로신 키나제 억제제(TKI)로, 주로 만성골수성백혈병(CML)과 특정 위장관기질종양(GIST)을 치료하는 표적치료제이다. 필라델피아 염색체(Ph+)로 인한 BCR-ABL 융합 단백질의 활성을 차단하여 암세포 증식을 억제한다. CML 치료에서 혁신적 약물로, 완전혈액학적반응(CcR) 및 분자적 반응(MR) 달성률이 높다 (IRIS 연구). GIST에서 c-KIT 돌연변이 표적, 수술 불가능/전이성 GIST에 효과적이며 경구 투여로 환자 편의성이 높다. 이매티닙은 BCR-ABL 돌연변이 확인 후 사용되며, 정기적인 분자 검사(예: BCR-ABL PCR)로 치료 반응 모니터링이 필수적이다.
면역항암제(Immunotherapy)는 면역 체계를 활성화하거나 조절하여 암세포를 공격하도록 유도하는 항암 치료제이다. 기존 화학항암제나 표적치료제와 달리 암세포 자체가 아닌 면역 시스템을 표적으로 하여 암의 성장을 억제하거나 제거한다.
면역항암제는 바이오마커 검사(예: PD-L1, MSI-H, TMB) 결과에 따라 적합성 결정이 이루어지며, 병용 요법(예: 니볼루맙+이필리무맙, 면역항암제+화학요법)이 효능 향상에 사용된다. 면역관문억제제는 PD-1/PD-L1 또는 CTLA-4 경로를 차단하여 암세포가 T세포를 비활성화시키는 것을 막으며, CAR-T 요법은 T세포를 특정 암 항원(예: CD19)에 반응하도록 개조하는 것이다. 또한, 사이토카인 요법과 암 백신은 면역 세포의 활성 또는 항원 인식을 증강하는 것이다.
호르몬 요법(Hormone Therapy)은 암세포의 성장을 촉진하는 호르몬의 생성 또는 작용을 억제하여 암의 진행을 늦추거나 억제하는 항암 치료법이다. 주로 호르몬 수용체(에스트로겐 수용체, 프로게스테론 수용체, 안드로겐 수용체 등)가 발현된 암, 특히 유방암과 전립선암 치료에 사용된다. 호르몬 요법은 암세포가 호르몬에 의존해 성장하는 특성을 표적으로 하며, 단독 또는 다른 치료(화학요법, 표적치료제)와 병용된다.
유방암의 경우에는 에스트로겐/프로게스테론 수용체를 차단하거나 에스트로겐 생성을 억제하여 암세포의 성장을 억제하며, 전립선암에서는 테스토스테론 생성 또는 안드로겐 수용체 활성을 차단하여 암세포의 증식을 억제한다. 또한, 특정 암에서 호르몬 경로 조절로 항암 효과를 기대할 수 있는 경우도 있다.
호르몬 수용체 양성 암에서 높은 효과를 나타내며, 경구 투여로 편리하고, 부작용이 화학요법보다 경미한 장점이 있다. 그러나 호르몬 수용체 음성 암에는 효과가 없으며, 내성 발생(예: 거세저항성 전립선암, CRPC), 장기 사용 시 골다공증/심혈관 문제 위험이 있다. 내성 시 다른 호르몬 요법(예: 2세대 항안드로겐제) 또는 표적치료제(CDK4/6 억제제, mTOR 억제제) 병용을 고려하여야 한다.
| 타겟별 대표 약물들과 특징 |
|---|
|
1. 핵(Nucleus) 표적 약물 🔹 작용부위/메커니즘: DNA 손상, DNA 복제/전사 차단, DNA 관련 단백질 억제 등 🔹 대표약물: • 알킬화제 (Alkylating agents): cyclophosphamide, cisplatin, carboplatin, oxaliplatin • 항대사체(antimetabolites): 5-fluorouracil, gemcitabine, methotrexate • DNA 복구 억제제: PARP 억제제 (예: olaparib, niraparib) • HDAC 억제제: vorinostat, panobinostat ⚠️ 특징 및 유의사항: • 골수억제, 구역/구토, 탈모 등이 흔함 • 특정 약물은 간독성/신독성 유발 가능 • 세포주기 비특이적/특이적인 것 구분 중요 |
|
2. 세포질 / 막 Protein & Signaling Pathways 표적 🔹 작용부위/메커니즘: 미세소관(tubulin), 세포내 신호전달(TK, mTOR, MEK, PI3K 등), 호르몬 수용체 등 🔹 대표약물: • Tubulin 작용제: taxanes (paclitaxel, docetaxel), vinca alkaloids (vincristine, vinblastine) • TKI (tyrosine kinase inhibitors): EGFR-TKI (erlotinib, osimertinib), ALK inhibitors (alectinib, brigatinib, ceritinib), BRAF (vemurafenib, dabrafenib), MEK inhibitors • 호르몬 수용체 길항제 (anti-androgens, antiestrogens, SERMs/SERDs): tamoxifen, fulvestrant, enzalutamide ⚠️ 특징 및 유의사항: • 표적 돌연변이 있는 환자에서 매우 효과적 • 내성(resistance) 문제 많음 (예: 돌연변이, bypass pathway) • 부작용도 표적의 정상 조직 발현 존재 시 있음 (예: EGFR TKI 피부 발진, 폐독성) |
|
3. 혈관(endothelium) / 항혈관 생성(Antiangiogenesis) 🔹 작용부위/메커니즘: 혈관 내피 성장 인자 수용체(VEGFR), 기타 혈관 형성 조절자 🔹 대표약물: • VEGFR TKI: sunitinib, sorafenib, axitinib, pazopanib 등 • Monoclonal 항체: bevacizumab (VEGF 억제) ⚠️ 특징 및 유의사항: • 고혈압, 출혈, 단백뇨 등의 혈관 관련 부작용 유의 • 다른 치료와 병용 시 상승된 독성 가능성 |
|
4. 면역계 타깃 / 면역치료 🔹 작용부위/메커니즘: 면역관문(checkpoint) 억제제, T세포 조작, 백신, cytokine 등 🔹 대표약물: • Immune checkpoint inhibitors: PD-1 (pembrolizumab, nivolumab), PD-L1 (atezolizumab, durvalumab), CTLA-4 (ipilimumab), 최근 LAG3(relatlimab) 등 • CAR-T therapy: axicabtagene ciloleucel, tisagenlecleucel 등 • 면역 조절 약물: lenalidomide, thalidomide 등 • 항체-약물 접합체(ADC): 예, trastuzumab-emtansine, sacituzumab govitecan 등 ⚠️ 특징 및 유의사항: • 면역 관련 이상반응(irAE) 주의 (피부, 위장, 폐, 내분비 등) • CRS (사이토카인 방출 증후군) 등 고위험 치료는 전문센터 경험 중요 • 치료 반응 시간 및 예측 인자 (tumor mutational burden, PD-L1 expression 등) 중요. |
|
5. 내분비 / 호르몬 치료 🔹 작용부위/메커니즘: 암세포의 호르몬 의존성 조절 🔹 대표약물: • 유방암 관련: tamoxifen, aromatase inhibitors(letrozole, anastrozole) • 전립선암 관련: enzalutamide, abiraterone 등 ⚠️ 특징 및 유의사항: • 호르몬 수용체 양성/호르몬 의존성 암에서만 효과 • 내성 발생 가능성, 대사 변화(예: 간, 지질) 또는 호르몬 변화 부작용 있음. |
Alectinib (알렉티닙, 상품명: Alecensa, 알레센자캡슐 150mg)은 ALK+ 비소세포폐암의 1차 치료 표준제 중 하나로, 특히 뇌 전이 환자에서 효과적이다. 크리조티닙 대비 CNS 침투율이 뛰어나며, 부작용은 간독성·근육독성·서맥이 주요 포인트이다.
Alectinib는 비정상 림프종 키나제(ALK) 단백질의 활동을 차단하여 특정 암세포의 성장을 억제한다. Chugai Pharmaceutical Co.에서 개발되었으며, 2015년에 크리조티닙(crizotinib)에 반응하지 않거나 내성이 생긴 환자들을 위해 가속 승인되었다.
알렉티닙은 ALK 인산화 및 STAT3, AKT와 같은 하위 신호 단백질을 억제하여 종양 세포의 생존 가능성을 줄인다. 알렉티닙과 그 활성 대사체(M4)는 다양한 ALK 돌연변이 및 융합에 효과적이다. 주로 간 효소 CYP3A4에 의해 대사되며, 혈장 단백질 결합률은 99% 이상이다.
태아에 해를 끼칠 수 있으므로, 치료 중 및 종료 후 3개월 동안 효과적인 피임을 사용해야 합니다(남녀 모두). 또한, 케토코나졸, 리팜핀 등 강력한 CYP3A4 억제제/유도제는 알렉티닙 및 M4 농도를 변화시키므로 피해야 한다. 소아에서의 안전성과 효능은 확인되지 않았으며, 고령자: 특별한 연령 관련 문제는 없으나, 모니터링이 필요하다.
| Alectinib |
|---|
|
1. 분류 🔹 ALK(Anaplastic Lymphoma Kinase) 티로신 키나아제 억제제(TKI) 🔹 2세대 ALK 억제제 🔹 표적항암제 |
|
2. 적응증 ① ALK 양성 비소세포폐암(NSCLC) 환자 치료 👉 진행성/전이성 환자 👉 1차 치료 또는 크리조티닙(crizotinib) 치료 실패 후 사용 가능 ② 뇌혈관 장벽(BBB)을 잘 통과하므로 중추신경계 전이 효과가 우수 |
|
3. 기전 🔹 ALK 융합 유전자(예: EML4-ALK)에 의해 과활성화된 ALK 단백질을 선택적으로 억제 🔹 암세포 증식, 생존 신호를 차단하여 종양 억제 🔹 CNS 전이 억제에 강점 (크리조티닙 대비 뇌 전이 억제 효과 ↑) |
|
4. 용법 🔹 성인 권장 용량: 👉 600mg 하루 2회(총 1200mg), 음식과 함께 복용 🔹 캡슐 형태 |
|
5. 약동학 🔹 대사: CYP3A4에 의해 부분적으로 대사 🔹 배설: 주로 대변으로 배설 🔹 Tmax: 약 4~6시간. 👉 복용 후 4~6시간 내 최고 혈중 농도에 도달하며, 약 7일 후 안정 상태에 도달. 🔹 단백결합률: >99% |
|
6. 주요 이상반응 🔹 피로, 변비, 부종 🔹 빈혈, 근육통, 근육효소(CPK) 상승 🔹 간독성 (AST/ALT, 빌리루빈 상승) → 간기능 모니터링 필요 🔹 폐렴(간질성 폐질환, ILD) 드물게 발생 🔹 서맥 |
|
7. 약물상호작용 🔹 CYP3A4 유도제/억제제와 상호작용 가능 👉 강력한 CYP3A 억제제: alectinib 혈중 농도 ↑ 👉 강력한 CYP3A 유도제: alectinib 혈중 농도 ↓ (효과 감소) 🔹 위산분비 억제제(PPI 등)와의 유의미한 상호작용은 크지 않음 |
|
8. 모니터링 🔹 간기능 검사 (AST, ALT, 빌리루빈) 🔹 CPK (근육독성 확인) 🔹 심전도/심박수 🔹 혈색소, 혈액검사 |
리보시클립(Ribociclib) (키스칼리정®)은 호르몬 수용체 양성(HR+), 인간 상피세포 성장인자 수용체 2형 (HER2) 음성 진행성(전이성) 유방암 환자에서 전체 생존율(OS)을 유의하게 향상시키는 효과가 있는 것으로 입증되었다.
호르몬 수용체 양성(HR+), HER2 음성(HER2-) 조기 유방암(early breast cancer, EBC) 환자에서 리보시클립(ribociclib, CDK4/6 억제제) + 내분비 요법(endocrine therapy, ET)의 보조 요법(adjuvant therapy) 효과를 평가한 NATALEE(Phase III 무작위 대조 시험)의 결과, 리보시클립 + ET가 Stage II-III HR+/HER2- EBC에서 iDFS를 유의미하게 개선함이 입증되었으며, CDK4/6 억제제의 보조 요법 확대를 뒷받침하는 것으로 나타났다. 특히 N0((node-negative) 환자 포함으로 광범위한 적용이 가능한 것으로 보고되었다. 이는 CDK4/6 억제제를 고위험 EBC에서 넓은 범위(Stage II-III, 림프절 음성 포함)로 확대 적용한 중요한 연구임을 의미한다.
이 연구에서 리보시클립(Ribociclib)과 비스테로이드성 방향화효소 억제제(NSAI: nonsteroidal aromatase inhibitor; letrozole, anastrozole)의 병용 요법은 호르몬 수용체 양성(HR+), HER2 음성인 Ⅱ기 또는 Ⅲ기 초기 유방암 환자에서 침습성 무병생존율 (invasive disease–free survival, iDFS)을 유의하게 향상시켰다.
리보시클립과 비스테로이드성 아로마타제 억제제(NSAI) 병용 요법은 NSAI 단독 요법에 비해 iDFS에서 유의미한 이점을 보였다.
3년 시점에서 침습성 질환 없는 생존율은
1. 리보시클립 + NSAI 병용 요법에서 90.4%
2. NSAI 단독 요법에서 87.1%
인 것으로 보고되었다(침습성 질환, 재발 또는 사망에 대한 위험비(HR) = 0.75; 95% 신뢰구간(CI) = 0.62~0.91; P=0.003).
2차 평가변수인 원격 질환 없는 생존율(Distant Disease-Free Survival, DDFS)과 재발 없는 생존율(Recurrence-Free Survival, RFS) 역시 리보시클립 + NSAI 병용 요법이 더 유리한 결과를 보였으며, 400mg 시작 용량의 리보시클립과 NSAI를 3년간 병용한 요법은 새로운 안전성 문제를 동반하지 않는 것으로 평가되었다.
리보시클립은 CYP3A4 기질이자 약한 억제제/유도제로, 다른 약물과 병용 시 혈중 농도 변화(리보시클립 또는 병용 약물) 가능성이 있다. 리보시클립은 CYP3A4 기질로, 강력 억제제(리토나비르) 또는 유도제(리팜피신)와 병용 시 약동학이 크게 변화하는 것으로 보고되었다. 리보시클립은 약한-중간 CYP3A 억제제로, 민감 기질(미다졸람, 에베롤리무스) 농도 증가 유발. 타목시펜과는 유의미한 DDI 없음.
| Ribociclib Drug-Drug Interactions |
|---|
|
1. 리보시클립 as Victim (CYP3A4 기질로서): • 강력 CYP3A 억제제 (리토나비르): - 리보시클립 AUC 3.2배 증가, Cmax 1.7배 증가. - 권고: 강력 CYP3A 억제제 병용 시 리보시클립 용량 감소(예: 600mg → 400mg). • 중간 CYP3A 억제제 (에리트로마이신): - AUC 1.3배 증가, Cmax 소폭 증가. - 권고: 용량 조절 필요성 낮음, 모니터링 권장. • 강력 CYP3A 유도제 (리팜피신): - AUC 89% 감소, Cmax 62% 감소. - 권고: 강력 유도제 병용 금지(효능 저하 우려). • PBPK(Physiologically-Based Pharmacokinetic) 예측: - 임상 결과와 일치, 약한/중간 유도제(예: 에파비렌즈) 시 AUC 50-70% 감소 예측. |
|
2. 리보시클립 as Perpetrator (CYP3A4 억제제/유도제로서): • 미다졸람 (CYP3A 기질): - 리보시클립 600mg 투여 시 미다졸람 AUC 3.8배 증가 (약한-중간 억제). - 권고: 민감 CYP3A 기질 병용 시 주의, 용량 조절 또는 대체 약물 고려. • 에베롤리무스: - AUC 2.5배 증가. - 권고: 병용 시 에베롤리무스 용량 감소 또는 모니터링 . • PBPK 결과: - 리보시클립은 시간 의존적 CYP3A 억제제(time-dependent inhibitor)로, 단기 억제 후 약한 유도 가능성. |
|
3. 타목시펜과의 DDI: - 리보시클립은 타목시펜 대사(CYP3A4로 활성 대사체 엔독시펜 형성)에 유의미한 영향 없음. - 권고: 타목시펜과 병용 가능, 추가 모니터링 불필요. |
|
4. 임상적 시사점: • 강력 CYP3A 억제제 병용 시 리보시클립 용량 감소(400mg 권장). • 강력 유도제 병용 금지. • 민감 CYP3A 기질 병용 시 대상 약물 용량 조절 또는 대체. • PBPK 모델링은 임상 DDI 시험 대체 및 라벨링 최적화에 유용. |
티슬렐리주맙(Tislelizumab) 은 중국 바이오 제약사 BeiGene(베이지니)에서 개발한 항-PD-1 단클론 항체로, 면역관문억제제(Immunotherapy)의 일종이다. 암세포가 면역세포(T세포)의 PD-1 수용체를 PD-L1/PD-L2 리간드로 억제하는 메커니즘을 차단하여, 면역세포가 암세포를 인식하고 공격할 수 있도록 한다. 이는 기존 항암제와 달리 면역계를 활성화하는 방식으로 작용하며, Fcγ 수용체 결합을 최소화한 구조로 항체 의존성 세포제거(ADCP)로 인한 치료 저항성을 줄였다.
| Tislelizumab |
|---|
|
1.특징: • 항-PD-1 단클론 항체. • 암세포의 PD-L1/PD-L2와 T세포의 PD-1 간 결합을 차단하여 면역계가 암세포를 공격하도록 활성화. • 구조적 차별화: Fcγ 수용체(FcγR) 결합 부위를 변형하여 항체 의존성 세포제거(ADCP)로 인한 T세포 소실을 최소화. 이는 기존 항-PD-1 약물(예: 니볼루맙, 펨브롤리주맙) 대비 면역 효과를 강화. |
|
2. 작용 기전: • 면역 활성화: PD-1 차단을 통해 T세포의 항종양 반응을 촉진, 사이토카인 분비 증가. • 종양 미세환경 조절: 면역 억제 환경을 완화하여 암세포 사멸 유도. • 투여: 정맥 주사, 3주 간격(200mg 기준). |
|
3. 임상적 효능: • 주요 적응증: - 고전적 호지킨 림프종(cHL): 화학요법 실패 후 2차 치료로 중국 승인 (2019). 객관적 반응률(ORR) 87.1%, 완전 반응률(CR) 62.9% (BGB-A317-203 연구). - 요로상피암(UC): PD-L1 고발현, 백금제 치료 후 진행 환자에서 ORR 24.8%, 질병 통제율(DCR) 48.6% (BGB-A317-204 연구). - 비소세포폐암(NSCLC): 백금제 병용 1차 치료로 ORR 57%, 무진행 생존기간(PFS) 7.6개월 (RATIONALE 307). - 간세포암(HCC): 단독 요법으로 ORR 13.8%, PFS 2.7개월 (RATIONALE 208). • 기타 암종: 위암, 식도암, 대장암 등에서 임상시험 진행 중. 특히 MSI-H/dMMR 종양에서 유망. |
|
4. 장점 - FcγR 변형 효과: 기존 항-PD-1 항체 대비 면역세포 소실 감소, 더 강한 항종양 효과. - 안전성: 부작용 프로필이 기존 PD-1 억제제와 유사하나, 면역 관련 부작용(예: 간염, 폐렴) 관리 가능. - 비용 효율성: 중국 시장 중심으로 경제적 접근성 우수. |
|
5. 한계: - 적응증 제한: 2022년 기준 주로 cHL, UC, NSCLC에 국한. 내장 전이 효과는 추가 데이터 필요. - 면역 관련 부작용: 간염, 폐렴, 피부 반응 등 3-4등급 부작용 드물지만 주의. |
📚 References
Gach-Janczak K, Drogosz-Stachowicz J, Janecka A, Wtorek K, Mirowski M. Historical Perspective and Current Trends in Anticancer Drug Development. Cancers (Basel). 2024 May 15;16(10):1878.
Chetana Sanjai, Sushruta S. Hakkimane, Bharath Raja Guru, Santosh L. Gaonkar, A comprehensive review on anticancer evaluation techniques, Bioorganic Chemistry, Volume 142, 2024, 106973, ISSN 0045-2068,
Rehman FU, Al-Waeel M, Naz SS, Shah KU. Anticancer therapeutics: a brief account on wide refinements. Am J Cancer Res. 2020 Nov 1;10(11):3599-3621.
Dong Z, Zhang X, Zhang Q, Tangthianchaichana J, Guo M, Du S, Lu Y. Anticancer Mechanisms and Potential Anticancer Applications of Antimicrobial Peptides and Their Nano Agents. Int J Nanomedicine. 2024;19:1017-1039.
Corsello, S.M., Nagari, R.T., Spangler, R.D. et al. Discovering the anticancer potential of non-oncology drugs by systematic viability profiling. Nat Cancer 1, 235–248 (2020).
Dennis Slamon et al. Ribociclib plus Endocrine Therapy in Early Breast Cancer. N Engl J Med 2024;390:1080-1091.
Samant TS, Huth F, Umehara K, Schiller H, Dhuria SV, Elmeliegy M, Miller M, Chakraborty A, Heimbach T, He H, Ji Y. Ribociclib Drug-Drug Interactions: Clinical Evaluations and Physiologically-Based Pharmacokinetic Modeling to Guide Drug Labeling. Clin Pharmacol Ther. 2020 Sep;108(3):575-585.
Johnson DB, Puzanov I, Kelley MC. Talimogene laherparepvec (T-VEC) for the treatment of advanced melanoma. Immunotherapy. 2015;7(6):611-9.
Zhang T, Jou TH, Hsin J, Wang Z, Huang K, Ye J, Yin H, Xing Y. Talimogene Laherparepvec (T-VEC): A Review of the Recent Advances in Cancer Therapy. J Clin Med. 2023 Jan 31;12(3):1098.
Zhang L, Geng Z, Hao B, Geng Q. Tislelizumab: A Modified Anti-tumor Programmed Death Receptor 1 Antibody. Cancer Control. 2022 Jan-Dec;29:10732748221111296. doi: 10.1177/10732748221111296. PMID: 35926155; PMCID: PMC9358212.