 도파민
(Dopamine)은 단일아민 카테콜아민 신경전달물질이자 호르몬으로, 다양한 수용체에 작용하여 여러 생리적 기능을 조절(보상, 운동 조절, 동기 부여, 인지 기능 등)에 관여한다.
도파민
(Dopamine)은 단일아민 카테콜아민 신경전달물질이자 호르몬으로, 다양한 수용체에 작용하여 여러 생리적 기능을 조절(보상, 운동 조절, 동기 부여, 인지 기능 등)에 관여한다.세포 간 통신은 생존을 위해 매우 중요하며, 이는 수용체 → 신호전달경로 → 세포응답이라는 과정으로 이루어진다.
도파민 수용체 (Dopamine Receptors)는 뇌 영역의 기저핵(basal ganglia), 변연계(limbic system), 시상하부(hypothalamus) 등에 고밀도로 분포하는 등 중추신경계와 말초신경계 전반에 걸쳐 존재하는 G-단백질 결합 수용체(GPCR) 계열로 도파민 신호를 받아 여러 생리·정신 기능을 조절한다.
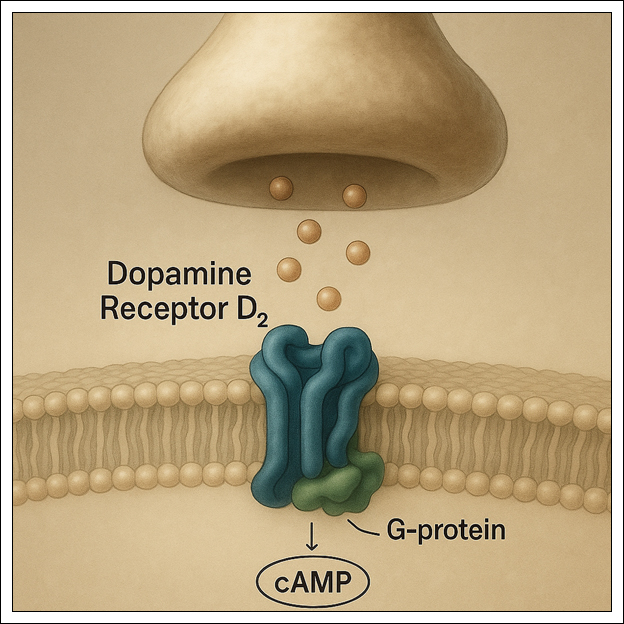
대부분의 도파민 수용체는 세포막을 7회 횡단하는 나선 구조[7회 막횡단 도메인(7TM) 구조]를 가지고 있으며, G-단백질 독립적 메커니즘(예: 이온채널 조절)도 가질 수 있다.
도파민 수용체의 기능적 아형 분류(D₁ 계열 vs D₂ 계열)가 신호전달 메커니즘과 임상적 의미를 이해하는 데 유용하며, 구조적·기능적으로 D1 계열(D1, D5) 수용체와 D2 계열(D2, D3, D4) 수용체의 두 하위군으로 나눈다.
D1 계열 수용체는 흥분성 (cAMP 증가)이며 D2 계열 수용체는 억제성 (cAMP 감소) 이다.
| 도파민 수용체의 기본 분류 |
|---|
|
⚙️ D₁ 계열 • 수용체 종류: D₁, D₅ • G 단백질: Gs • 세포내 작용: Gs/Golf 단백질 활성화 → 아데닐산 사이클라아제(adenylyl cyclase, AC) 자극 → cAMP 증가 → PKA 활성화 → CREB 인산화 (유전자 전사 촉진). • 대표적 작용 위치: 선조체(striatum), 피질(cortex) • 주요 기능: 흥분성 신호 (신경 흥분 촉진, 행동 활성, 운동 촉진, 보상 강화). |
|
⚙️ D₂ 계열 • 수용체 종류: D₂, D₃, D₄ • G 단백질: Gi/o • 세포내 작용: - Gi/Go 단백질 활성화 → AC 억제 → cAMP 감소. - 추가: 칼륨 채널 열림 (과분극), 칼슘 채널 차단 (전도도 ↓). • 대표적 작용 위치: 시상하부, 변연계, 뇌하수체 • 주요 기능: 억제성 신호 (운동 억제, 호르몬 조절, 신경 억제, 프로락틴 억제, 보상·중독 조절) |
|
⚙️ 비-cAMP 경로: • β-arrestin 매개 MAPK/ERK 경로 (세포 증식 관련). |
다양한 신경정신질환 및 신체질환(예: 고혈압, 신장기능 이상)에서도 도파민 수용체가 역할을 할 수 있으므로, 수용체-약물 상호작용에 대한 이해는 임상적 응용 가능성이 높다.
CNS에서는 D₁이 가장 많이 발현되고, 그 다음이 D₂, D₃, D₅, D₄ 순으로 낮다.
D₁ 및 D₅는 선조체(striatum), 측좌핵(nucleus accumbens), 후각망울(olfactory bulb), 흑질(substantia nigra) 등에 고밀도로 존재한다.
| Dopamine 수용체별 세부 기능 |
|---|
|
⚙️ D₁ • 주요 위치: 선조체, 피질 • 기능: 인지 기능 향상, 기억, 주의, 충동조절, 신장기능 조절, 운동 활력 조절. • 임상 관련성: 파킨슨병. 도파민 결핍 시 감소 |
|
⚙️ D₂ • 주요 위치: 선조체, 뇌하수체, 변연계 • 기능: 운동 억제, 운동 조절, 프로락틴억제, 주의, 수면, 학습, 기억 • 임상 관련성: 항정신병약(예: 할로페리돌)은 D₂차단 → 추체외로 부작용, 고프로락틴혈증 |
|
⚙️ D₃ • 주요 위치: 변연계(측좌핵, 전전두엽) • 기능: 감정·보상·중독 • 임상 관련성: 약물중독·충동조절장애 관련(인지, 충동조절, 주의, 수면). |
|
⚙️ D₄ • 주요 위치: 전전두엽, 변연계 • 기능: 인지·집중 • 임상 관련성: ADHD 관련성 연구됨. 인지, 기억, 공포, 충동조절, 주의, 수면. |
|
⚙️ D₅ • 주요 위치: 해마, 시상하부 • 기능: 학습, 기억, 내분비 조절 • 임상 관련성: 상대적으로 연구 적음. 의사결정, 인지, 주의, 레닌 분비 조절. |
수용체 계열 및 G 단백질 연계에서, D1-like 계열 (D1, D5)은 주로 Gα_s 및 Gα_olf와 결합하여 아데닐릴사이클레이스(adenylyl cyclase) 활성 → cAMP 증가 → PKA (cyclic AMP-dependent protein kinase) 활성화 → 단백질인산화 증가 → 다양한 수용체·효소·이온채널·전사인자 등을 조절한다.
또한 D1 계열 수용체는 PLC(포스포리파제 C)-의존적이면서 cAMP 독립적인 세포내 Ca²⁺ 동원의 경로도 가질 수 있음이 제시되어 있다.
D2-like 계열 (D2, D3, D4)은 주로 Gα_i 및 Gα_o와 결합하며, 아데닐릴사이클레이스 억제를 통해 cAMP 수준을 낮추는 한편, Gβγ 서브유닛이 유리되면서 이온채널, 인지질분해효소(phospholipases), 단백질키나아제, 수용체 티로신키나아제 등 다양한 이펙터(effector)들을 조절한다.
신호전달 경로 및 기능에서 도파민 수용체는 cAMP 외 다중 경로(MAPK, PLC, 이온 채널)로 신호를 전달한다.
D1-like 수용체가 활성화되면 DARPP-32 (dopamine- and cAMP-regulated phosphoprotein of 32 kDa) 등의 인산화 억제자(inhibitor) 단백질이 활성화되어 단백질인산화 증가가 일어나고, 이를 통해 많은 하위 경로가 조절된다.
D2-like 수용체의 경우, 단순히 cAMP 경로 억제 뿐 아니라 Gβγ 매개 경로를 통해 막전위 조절(이온채널 조절), MAPK/ERK 경로, 수용체 내부화(internalization) 및 수용체 올리고머화(oligomerization) 등 다양한 복합 조절이 이루어진다.
또한 수용체 자체의 조절(예: 수용체-수용체 상호작용, 수용체-스캐폴딩(scaffolding) 단백질 및 신호전환 단백질(signal-switching proteins)과의 상호작용)이 도파민 수용체 신호전달의 정밀 조절에 매우 중요한 역할을 한다.
아형 특이성, 이소폼(isoform) 차이, 이종복합체 형성이 기능적 다양성의 핵심이며, 선택적 약물 개발을 위해 신호별 편향(biased signaling) 연구가 필요하다.
|
생리적 경로 (도파민 시스템 4가지) |
|---|
|
⚙️ 니그로스트리아탈(nigrostriatal) 경로 • 기원 → 종착지: 흑질 → 선조체 • 주요 기능: 운동 조절 • 관련 질환: 파킨슨병 |
|
⚙️ 메솔림빅(mesolimbic) 경로 • 기원 → 종착지: 복측피개부(VTA) → 측좌핵 • 주요 기능: 보상, 중독, 쾌감 • 조현병(양성증상) |
|
⚙️ 메소피질(mesocortical) 경로 • 기원 → 종착지: VTA → 전전두엽 • 주요 기능: 인지, 동기, 감정 • 조현병(음성증상, 인지결함) |
|
⚙️ Tuberoinfundibular 경로 • 기원 → 종착지: 시상하부 → 뇌하수체 • 주요 기능: 프로락틴 억제 • D₂ 차단 시 → 고프로락틴혈증 |
조절 메커니즘 및 상호작용과 관련하여 수용체의 올리고머화 또는 이종복합체(heteromer) 형성 가능성이 있으며, 이는 수용체의 리간드 민감성(ligand sensitivity), 신호효율(efficiency), 내부화(internalization) 및 하위 신호전달 선택성(selectivity)에 영향을 줄 수 있다.
수용체 신호전달 외에도 이온채널 조절(예: K⁺ 채널, Ca²⁺ 채널), 전사조절(transcription factors 활성화), 세포 내 칼슘동원(calcium mobilization) 등이 중요한 하위 결과로 제시되고 있다.
도파민 수용체 신호전달은 운동조절, 인지기능, 보상 및 중독 메커니즘, 내분비계 조절 등 다양한 생리기능에 관여하며, 항정신병제, 파킨슨병 치료제 등 도파민 수용체를 표적으로 한 약물개발 및 작용기전 이해에 있어서, 이러한 신호전달 경로의 복잡성이 중요한 고려사항이다.
| 생리학적 역할 |
|---|
| • 운동 조절: 기저핵에서 D1/D2 불균형 → 파킨슨병/헌팅턴병. |
| • 보상/중독: 중뇌-변연계 (VTA-NAc)에서 D1/D2 활성화 → 약물 남용 (코카인, 암페타민). |
| • 내분비: D2 → 프로락틴 억제 (뇌하수체). |
| • 혈관/신장: D1 → 나트륨 배설 촉진 (고혈압 예방). |
Zeng와 Jose(2010)는 도파민 수용체가 신장과 혈관에서 항고혈압 작용을 한다는 것을 입증하였다. D1-like(D1, D5)는 근위세뇨관에서 NHE3, Na⁺/K⁺-ATPase를 억제하여 Na⁺ 배설을 촉진하고, D2-like(D2, D3, D4)는 교감신경과 알도스테론을 억제한다. SHR 및 D5/D3 KO 쥐에서 D1-like 기능 장애가 고혈압을 유발하며, 이는 AT1, 교감신경, 알도스테론과 균형을 이루는 도파민 시스템의 붕괴를 시사한다. Fenoldopam과 같은 D1 작용제는 이를 보완할 수 있는 치료 전략이다.
Fenoldopam은 D1 작용제로서 급성 고혈압 치료에 사용되며, Dopamine (저용량)은 D1-like 활성화로 신부전 시 Na⁺ 배설 촉진효과가 있다.
도파민 수용체는 신장 Na⁺ 배설과 혈관 긴장도를 조절하여 항고혈압 작용을 나타낸다. 고혈압에서 D1-like 기능 저하가 핵심 병인이 될 수 있으며, D1/D5 선택적 작용제는 항고혈압 치료제의 가능성이 있다.
|
약물과 도파민 수용체 |
|---|
|
⚙️ L-DOPA • 작용 기전: 도파민 전구체 ↑ • 임상효과/부작용: 파킨슨병 치료 |
|
⚙️ D₂ 작용제 (브로모크립틴, 카베르골린) • 작용 기전: D₂ 수용체 활성화 • 임상효과/부작용: 고프로락틴혈증, 파킨슨병 치료 |
|
⚙️ D₂ 길항제 (할로페리돌, 리스페리돈) • 작용 기전: D₂ 차단 • 임상효과/부작용: 항정신병 효과 / ⚠️ EPS, 고프로락틴혈증 유발 |
|
⚙️ D₃/D₄ 선택적 약물 (아립프라졸 등) • 작용 기전: 부분 작용제 • 임상효과/부작용: 음성증상 개선, 부작용 감소 |
|
⚙️ 도파민 재흡수 억제제 (코카인, 암페타민) • 작용 기전: 시냅스 내 도파민 ↑ • 임상효과/부작용: ⚠️ 각성, ⚠️ 중독, ⚠️ 정신병적 증상 가능 |
도파민 수용체의 이상 또는 과잉/결핍은 다양한 신경정신 및 신체 질환과 관련이 있다.
예를 들어, Parkinson’s disease(파킨슨병)은 흑질의 도파민이 감소하며, 도파민 수용체 작용을 증가시키는 약물(예: D₂ 작용제 등)이 치료에 사용된다.
Schizophrenia(조현병)는 도파민 D₂ 수용체 과활성 또는 관련 회로 이상이 양성 증상 및 항정신병 약물의 표적으로 지목된다.
D₂ 수용체 작용제, 즉 브로모크립틴(bromocriptine) 등은 고프로락틴혈증 치료 또는 파킨슨병에서 사용된다.
도파민 전구체(예: 레보도파 + 카비도파)는 파킨슨병에서 도파민 수준을 증가시켜 증상을 완화한다.
도파민 수용체는 중추신경계 질환의 핵심 타겟으로 D1/D2 선택적 약물 개발로 부작용을 최소화하는 연구가 진행중이며, 앞으로는 D3 특이적 약물 (중독 치료), 유전자 치료 (파킨슨) 등이 활성화 될 전망이다.
| 도파민 수용체 관련 질환 | 수용체 |
|---|---|
| ⚙️ 파킨슨병(운동 저하) |
• 수용체: D2 감소(↑ 필요) • 작용기전: 도파민 전구체, D2/D3 작용제 • 약물 예시: L-DOPA, Ropinirole |
| ⚙️ 조현병(환각/망상) |
• 수용체: D2 과활성 • 작용기전: D2 길항제 (정신증 완화) • 약물 예시: Haloperidol, Clozapine |
| ⚙️ ADHD(주의 산만) |
• 수용체: D4 변이 • 작용기전: 도파민 재흡수 억제 • 약물 예시: Methylphenidate |
| ⚙️ 중독(보상 과민) |
• 수용체: D1/D2 과민 • 작용기전: DAT[Dopamine Transporter: 도파민 재흡수 담당 (SLC6A3). Cocaine·Amphetamine 타겟.] 차단 → 도파민 축적 • 약물 예시: Cocaine, Amphetamine |
| ⚙️ 불안/우울(감정 조절 이상) | • 수용체: D3 |
| 타겟 수용체 | 약물/용도 예 |
|---|---|
| D2/D3 작용제 | Pramipexole / 파킨슨병 |
| D2 길항제 | Haloperidol / 조현병 |
| D2/D3 부분 작용제 | Aripiprazole / 조현병, 양극성 |
| D1/D2 ↑ 간접 작용 | Levodopa / 파킨슨병 |
| ⚠️ D2 차단 부작용 👉 | ⚠️ 추체외로 증상(운동 이상), 고프로락틴혈증. |
Yin 등(2020)은 lipid nanodisc 내 인간 D2R–Gi1 복합체의 3.0 Å cryo-EM 구조(PDB 6VMS)를 최초로 보고하였으며, GPCR(G Protein-Coupled Receptor)–G단백질 결합의 lipid 의존성을 규명하였다.
Bromocriptine이 Asp¹¹⁴³·³² 및 3개 세린(Ser¹⁹³⁵·⁴²,¹⁹⁴⁵·⁴³,¹⁹⁷⁵·⁴⁶)과 결합하며 TM6를 14 Å 외향 이동시키고, Gαi1의 α5 helix가 ICL2(Arg¹³⁵ 등)에 삽입된다. PIP₂가 정전기적으로 복합체를 안정화하며, nanodisc 환경은 detergent 대비 활성 상태를 선호한다. 기능적으로 bromocriptine은 Gi 활성화(EC₅₀ 12 nM) 및 cAMP 억제를 유도하며, 이는 D2R 신호전달의 지질 의존성을 입증한다.
GPCR는 7회 막횡단 도메인을 가진 세포막 수용체로, 도파민 수용체(D1–D5)는 모두 클래스 A GPCR에 속한다. 리간드 결합 시 TM6 외향 이동과 G단백질 결합을 통해 cAMP 조절 등 신호를 전달하며, 최근 cryo-EM 구조(예: D2R–Gi, 6VMS)는 지질 환경에서의 활성 상태를 명확히 보여준다.
향후 약물 개발이나 정신신경질환 치료에 있어 수용체 아형별 선택성, 신호전달 경로의 세부 조절(예: β-arrestin 경로, 이온채널 연계 등) 등이 중요한 연구 방향이 될 것으로 보인다.
📚 References
Bhatia A, Lenchner JR, Saadabadi A. Biochemistry, Dopamine Receptors. [Updated 2023 Jun 22]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Xu, P., Huang, S., Krumm, B.E. et al. Structural genomics of the human dopamine receptor system. Cell Res 33, 604–616 (2023).
Neve KA, Seamans JK, Trantham-Davidson H. Dopamine receptor signaling. J Recept Signal Transduct Res. 2004 Aug;24(3):165-205.
Yin, J., Chen, KY.M., Clark, M.J. et al. Structure of a D2 dopamine receptor–G-protein complex in a lipid membrane. Nature 584, 125–129 (2020).
Beaulieu, Jean-Martin et al. The Physiology, Signaling, and Pharmacology of Dopamine Receptors. Pharmacological Reviews, Volume 63, Issue 1, 182 - 217 (2011).
Chunyu Zeng and Pedro A. Jose. Dopamine Receptors: Important Antihypertensive Counterbalance Against Hypertensive Factors. Hypertension Volume 57, Number 1 (2010).
Zhuang, Youwen et al. Structural insights into the human D1 and D2 dopamine receptor signaling complexes. Cell, Volume 184, Issue 4, 931 - 942(2021).