 조현병
(schizophrenia)은 복합 유전적·후생유전적 요인들이 얽힌 만성 정신질환으로 환자의 기대 수명을 8~15년 단축시키며, 뇌신경전달계 이상, 산화 스트레스, 신경염증, 장-뇌 축 이상
등이 병인 기전으로 거론된다.
조현병
(schizophrenia)은 복합 유전적·후생유전적 요인들이 얽힌 만성 정신질환으로 환자의 기대 수명을 8~15년 단축시키며, 뇌신경전달계 이상, 산화 스트레스, 신경염증, 장-뇌 축 이상
등이 병인 기전으로 거론된다.특정 유전자 변이(예: MTHFR, COMT)는 영양소 대사(엽산, 비타민 B12 등)에 영향을 미쳐 정신분열증 증상 및 치료 반응에 기여할 수 있다. 유전-영양 상호작용(nutrigenomics)은 개인화된 영양 중재의 중요성을 강조한다.
조현병은 양성 증상(환각, 망상), 음성 증상(정서적 둔화, 사회적 위축), 인지 장애를 특징으로 하는 복잡한 정신질환으로 유전, 신경발달 이상, 환경적 요인(영양 결핍 포함)이 병인에 기여하며 항정신병약이 주요 치료법이나, 체중 증가, 대사 증후군, 심혈관 질환 등의 부작용이 문제로 대두되고 있다.
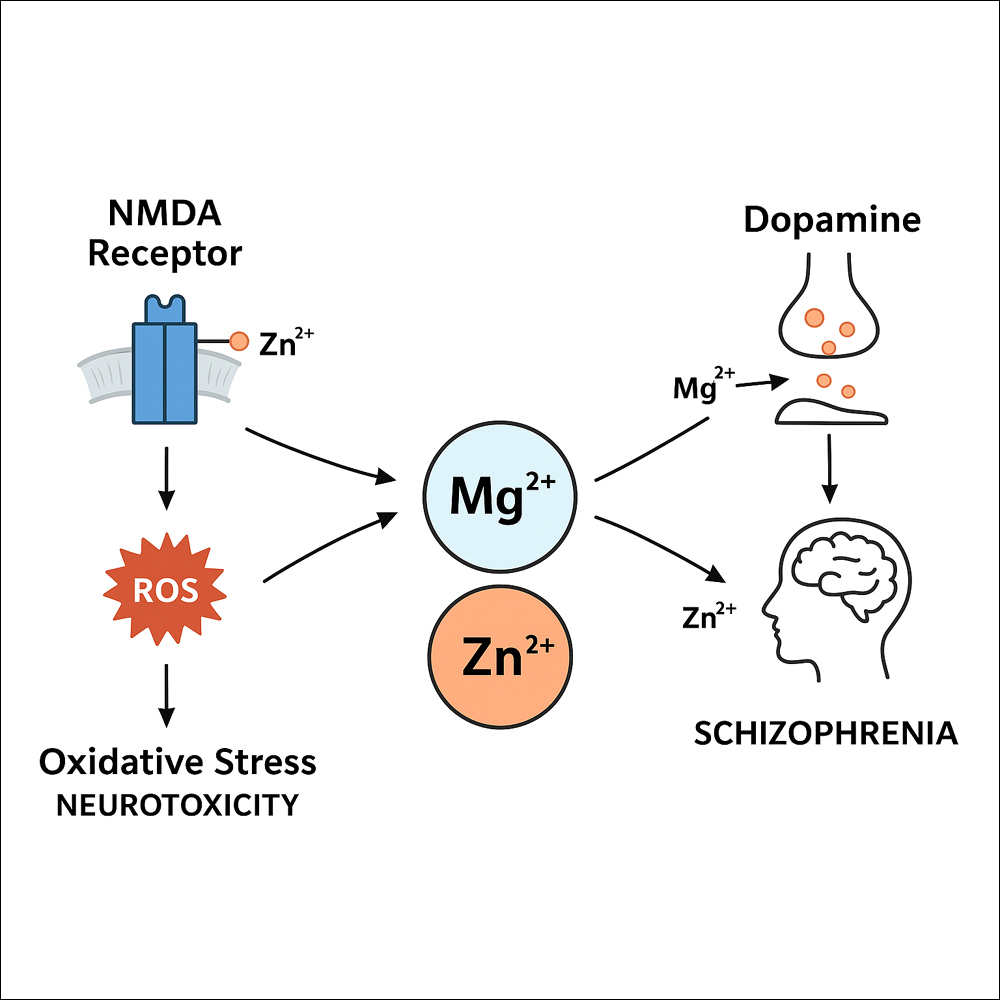
마그네슘(Mg²⁺)과 아연(Zn²⁺)은 중추신경계에서 다양한 조절 기능을 담당하는 필수 미량 무기 이온들이다.
루마니아의 약리학자 Mihai Nechifor는 조현병의 병인 및 진행 과정에서 Mg²⁺ 및 Zn²⁺가 어떤 역할을 할 수 있는지, 이들의 농도 변화 및 기전과 치료적 함의 가능성을 종합적으로 고찰하는 리뷰 논문(2025년)에서 Mg²⁺와 Zn²⁺가 조현병의 병인 및 증상 변화에 다양한 경로로 관여할 가능성이 크며, 특히 신경전달계 조절, 항산화 작용, 염증 반응 억제, 신경가소성 유지 등이 주요 매개 체가 될 수 있다고 보고하였다. 저자는 이 두 양이온의 결핍이 병인에 미치는 영향이 과소평가되었다고 지적하면서, 이를 신경전달물질 시스템, 신경염증, 산화 스트레스 등 다각도로 분석하였으며, 실험적·임상적 증거를 바탕으로 보충 요법의 잠재력을 제안하였다.
| Mg²⁺와 Zn²⁺의 생물학적 역할 |
|---|
| ⚙️ Mg²⁺는 600개 이상의 효소에 의존적이며, 주로 세포 내(99%)에 존재. 뇌척수액 농도는 혈청과 유사(1.25 mmol/L). |
| ⚙️ Zn²⁺은 300개 이상의 효소와 2000개 전사 인자의 보조인자로, 뇌 농도가 다른 장기보다 8~10배 높음(150 μmol/L). 뇌 시냅스에서 신경조절자로 작용. |
| ⚙️ 조현병 환자에서 Mg²⁺와 Zn²⁺ 농도는 이질적(일부 연구에서 낮음, 일부 정상)이나, 대부분 결핍 경향. Zn²⁺/Cu²⁺ 비율 불균형이 관찰됨. 임신 중 Zn²⁺ 결핍이 병인에 기여할 수 있음. |
Mg²⁺ 및 Zn²⁺ 농도 이상과 조현병 환자에서의 관찰에서 조현병 환자의 경우에 Mg 및 Zn의 혈장 또는 조직 내 농도가 낮다는 보고가 많다. 그러나 연구들 간의 결과는 이질적이다. 일부에서는 Mg 또는 Zn 농도가 환자군과 대 조군 사이에 유의한 차이를 보이지 않았다는 보고도 있다. Mg 및 Zn뿐 아니라 구리(Cu)와의 비율도 중요하며, 조현병에서는 Zn/Cu 비율이 낮 아지는 경향이 있다는 보고가 있다.
Mihai Nechifor는 논문에서 Mg와 Zn이 여러 신경전달 시스템에 미치는 영향을 중심으로 논의를 전개하였다.
| Mg²⁺ 및 Zn²⁺의 신경전달계 조절 기전 |
|---|
|
1. 도파민계 (Dopaminergic system) - Zn은 도파민 운반체(dopamine transporter)의 비경쟁적 억제자로 작용할 수 있으며, 실험 동물 연구에서 Zn이 일부 뇌 부위의 도파민 농도를 증가. - Mg는 스트레스 조건이나 칼슘 자극에 의해 유도되는 도파민 분비를 억제하는 역할을 할 수 있으며, Mg 농도 결핍 시 도파민 분비 과잉이 유도될 수 있다는 실험 결과 존재. |
|
2. 글루타메이트계 (Glutamatergic system) - Zn은 NMDA 수용체의 알로스테릭 억제자로 작용하며, 글루타메이트 신호 조절에 관여. - Mg 역시 NMDA 수용체의 칼슘 통로를 차단하는 역할을 하며, Mg 존재 하에 NMDA 과잉 활성화를 억제. |
|
3. 세로토닌계 (Serotonergic system) - Zn은 뇌 여러 부위에서 5-HT1A 수용체와 함께 공존하며, Zn 농도가 일정 수준 이상일 경우 5-HT1A 수용체의 작용을 억제. - MgCl₂ 투여는 일부 뇌 부위(예: 전전두엽, 초핵(accumbens) 등)에서 5-HT(세로토닌) 농도를 낮추는 경향을 나타냄. |
|
4. GABA계 (GABAergic system) - Mg는 GABA_A 수용체 작용을 증강시키는 효과가 있으며, GABA 신경전달 조절을 통해 과흥분 상태를 억제. - Zn 또한 GABA 신경 조절에 관련이 있으며, Zn 결핍이 GABA 계 조절을 손상시킬 가능성 존재. |
조현병에서는 항산화체계 저하와 활성산소종(ROS) 증가가 관찰된다. Mg 및 Zn은 항산화 작용을 하며, 그 부족은 산화 손상을 악화시킬 수 있다.
조현병 환자에서는 IL-1β, IL-6, TNF 등 신경 염증(Neuroinflammation) 유발 가능성이 있는 여러 염증성 사이토카인 수치가 증가하는 경향이 있다. Zn 및 Mg는 염증 반응 억제에 관여할 수 있으며, 결핍 시 염증 반응이 증폭될 수 있다.
신경가소성 및 세포 사멸 (Neuroplasticity / Apoptosis)과 관련하여 Zn은 신경세포 증식 및 사멸 억제에 관여하고, DISC1 (정신질환 관련 유전자)와도 연관될 수 있다. Zn 부족은 신경가소성 저하를 일으킬 수 있다. Mg 또한 세포 내 에너지 대사, 미토콘드리아 기능 조절 등을 통해 신경 생존 및 가소성에 영향을 줄 수 있다.
약물 상호작용에서 일부 항정신병 약물과 Mg / Zn 대사 간 상호작용이 보고된 바 있으므로 주의가 필요하지만, 특히 조현병 환자에서는 Mg, Zn 농도를 측정하고 부족 시 보충하는 것이 중요하다는 제언이 있다. 영양학적 섭취나 보충제 처방이 환자의 증상 조절 및 병의 진행에 긍정적 영향을 줄 여지가 있으나, 임상 근거는 아직 제한적이다.
Mg²⁺와 Zn²⁺는 조현병의 병인 및 증상 변화에 다양한 경로로 관여할 가능성이 크며, 특히 신경전달계 조절, 항산화 작용, 염증 반응 억제, 신경가소성 유지 등이 주요 매개체가 될 수 있다. 현재까지의 증거는 대부분 관찰적 또는 동물실험 수준이며, 인과관계 규명은 부족하다. 임상적으로 조현병 환자의 Mg / Zn 결핍 여부를 정기적으로 확인하고, 결핍 시 적절히 보충하는 전략이 고려될 수 있으며, 향후 무작위 대조시험(RCT) 등을 통한 보충 치료 효과 연구가 필요하다.
조현병(schizophrenia)은 기존 약물 치료만으로는 모든 증상이나 경과를 충분히 조절할 수 없는 경우가 많다.
영양(nutrition)은 비교적 조절 가능하고 보완적인 개입 가능성이 있는 요인으로 관심이 증가하고 있으며, 조현병의 발병, 진행, 치료 반응 및 예후에 영향을 줄 수 있다는 가설들이 제안되고 있다.
조현병은 도파민, 글루탐산, GABA 등 신경전달물질 시스템의 이상과 관련이 있으며, 영양소는 이러한 시스템의 조절에 관여한다.
조현병 환자는 일반인 대비 식습관이 좋지 않은 경향이 보고된다. 과도한 포화지방, 나트륨, 콜레스테롤 섭취, 식이섬유 부족, 가공식품 및 당류 과다 섭취 등이 지적된다. 이러한 비정상적 식습관은 대사증후군, 비만, 심혈관계 질환 위험 증가와 연결되어 있으며, 조현병 환자의 조기 사망률 증가 요인 중 하나로 여겨진다. 일부 연구에서는 오메가-3 지방산, 비타민 D 등이 적게 섭취되는 경향이 있다는 보고도 있다.
영양 결핍은 조현병의 위험 증가, 증상 악화, 치료 반응 저하와 연관. 특히 태아기 및 초기 발달 단계에서의 결핍이 신경발달 이상을 유발할 수 있으며 서구화된 식습관(고지방·고당·저영양 식이)은 조현병 환자의 대사 증후군 및 염증 반응을 악화시킬 수 있다.
특히 조현병 환자에서 호모시스테인(homocysteine) 수준이 증가된 경우가 보고되며, 이는 신경독성(neurotoxicity), 산화 스트레스 증가, 글루타메이트 경로 교란 등과 연결될 가능성이 있다. 또한, 조현병 환자에서는 이미 약물 사용 이전에도 이러한 영양소 수준 이상이 관찰된 경우가 있어, 약물 부작용만으로는 설명이 어려운 부분이 있다.
| 주요 영양소와 조현병 |
|---|
|
⚙️ 비타민 D: • 태아기 결핍이 조현병 위험 증가와 관련. • 혈중 농도 낮은 환자에서 증상 심각도↑. • 보충 요법은 일부 연구에서 인지 기능 및 음성 증상 개선. |
|
⚙️ 비타민 B군 (B6, B9, B12): • 호모시스테인 대사에 관여. • 결핍 시 신경염증 및 산화 스트레스 증가. • B9(엽산) 및 B12 보충이 음성 증상과 인지 기능 개선에 효과적일 수 있음(RCT 증거). • 비타민 B 계열, 엽산 등은 메틸기 공급원 및 대사체로 작용 → DNA 메틸화, 유전자 발현 조절 → 뇌 발달 및 기능 조절 영향 가능. |
|
⚙️ 비타민 C 및 E, 베타카로틴: • 항산화제로 산화 스트레스 감소. 비타민 C는 항정신병약 부작용 완화에 기여. |
|
⚙️ 아연(Zn²⁺): • NMDA 수용체 및 도파민 시스템 조절. • 결핍은 인지 저하 및 양성 증상 악화와 연관. • 보충(25~220 mg/일)은 리스페리돈과 병용 시 증상 개선(아연/구리 균형에 주의!). |
|
⚙️ 마그네슘(Mg²⁺): • NMDA 수용체 및 GABA 시스템 조절. • 결핍은 불안 및 인지 장애 악화. • 보충은 항정신병약 부작용(추체외로 증상) 감소. |
|
⚙️ 셀레늄 및 철: • 항산화(산화 스트레스 감소로 신경보호 효과) 및 도파민 합성에 관여. • 결핍은 드물지만, 조현병 환자에서 농도 감소 관찰. |
|
⚙️ 오메가-3 지방산: • 항염증 효과로 신경보호. • EPA/DHA 보충은 양성·음성 증상 및 인지 기능 개선에 유익(일부 RCT에서 긍정적 결과). |
|
⚙️ 아미노산: • 글루타민, 글라이신, D-세린은 NMDA 수용체 활성화로 증상 완화 가능. • 고용량 사용 시 부작용 주의. |
|
⚙️ 채식/식물성 식이: • 고섬유, 저포화지방 식이는 대사 건강 개선, 체중 관리에 유익. 항정신병약 유발 체중 증가 및 대사 합병증 완화 가능. |
|
⚙️ 저글루텐 또는 글루텐-프리 식이 • 일부 조현병 환자에서 글루텐 민감성과 증상 악화 연관성 제안. • 그러나 보편적 적용에는 추가 증거 필요. |
|
⚙️ 저탄수화물 식이: • 대사 증후군 관리에 도움될 수 있으나, 장기 효과 미확인. |
|
⚙️ 식물성/지중해식 식이: • 고섬유, 저포화지방 식이는 대사 건강 개선, 체중 관리에 유익. 항정신병약 부작용 완화 가능. |
|
⚙️ 케톤 생성 식이: • 대사 및 뇌 기능 개선 가능성 있으나, 정신병적 장애에서의 효과는 초기 연구 단계. |
비타민 B군, 오메가-3, 아연 보충은 일부 RCT에서 증상 개선 및 부작용 감소 효과가 확인되었으나 결과는 연구마다 이질적이다. WFSBP(World Federation of Societies of Biological Psychiatry) 지침은 비타민 B9, B12, 아연을 보충제로 권장하며 개인화된 영양 평가 및 모니터링이 필요하다
영양 상태 평가(혈중 비타민 D, B12, 아연 등)는 조현병 환자 관리의 필수 요소이며, 개별화된 영양 보충은 항정신병약과 병용 시 증상 완화 및 부작용 감소에 기여할 수 있다.
식이 개입은 체중 관리, 대사 건강 개선, 전반적 삶의 질 향상에 도움이 되며 Physicians Committee for Responsible Medicine은 식물성 식이와 영양 보충을 통한 비약물적 접근을 권장한다.
| 영양 결핍의 병인 기여 |
|---|
|
⚙️ 태아기 및 초기 결핍: • 비타민 D, 엽산, 철 결핍이 신경발달 이상을 유발, 조현병 위험↑. |
|
⚙️ 장-뇌 축: • 장내 미생물군 불균형(dysbiosis)이 염증 및 신경전달물질(도파민, 세로토닌) 이상을 유발하며, 이는 정신병적 증상과 연관. • 프로바이오틱스와 프리바이오틱스는 염증 감소와 증상 개선 가능. |
|
⚙️ 산화 스트레스 및 염증: • 영양 결핍은 뇌의 산화 스트레스와 신경염증을 증가시켜 증상 악화. |
|
⚙️ 대사 합병증: • 항정신병약은 체중 증가, 당뇨, 이상지질혈증 유발. • 영양 개입(저탄수화물·고섬유 식이)은 대사 건강 개선. |
결론적으로, 영양 결핍은 조현병의 병인, 진행, 치료 반응에 중요한 영향을 미칠 수 있으며, 비타민 D, B군, 아연, 마그네슘, 오메가-3 등의 보충이 증상 관리와 항정신병약 부작용 완화에 잠재적 이점이 있다. 그러나 영양 개입의 효과는 환자 특성, 결핍 정도, 치료 시점에 따라 달라지며, 표준화된 접근과 추가 연구가 필요하다. 영양 상태 평가와 개별화된 보충 요법은 조현병의 종합적 관리 전략에 통합되어야 한다.
조현병은 도파민 경로의 과활성(특히 mesolimbic pathway)과 피질 영역의 저활성(mesocortical pathway hypoactivity)이 병태생리의 중심으로, 치료의 핵심은 도파민 D₂ 수용체의 조절이다.
항정신병약물(antipsychotics)이 치료의 중심으로 약물은 양성 증상(망상, 환각, 와해된 사고)과 음성 증상(정서 둔마, 무의욕, 사회적 위축), 그리고 인지기능에 서로 다른 영향을 미친다. 비약물치료(정신사회적 개입, 인지행동치료 등)가 약물치료와 병행되어야 한다.
| 항정신병약물의 분류 |
|---|
|
⚙️ 1세대 항정신병약물(Typical, FGAs) • Chlorpromazine, Haloperidol, Fluphenazine 등. • 강한 D₂ 수용체 길항. • 양성 증상에 효과적. • ⚠️ EPS(추체외로 부작용) 흔함. |
|
⚙️ 2세대 항정신병약물(Atypical, SGAs) • Clozapine, Risperidone, Olanzapine, Quetiapine, Aripiprazole, Ziprasidone 등. • D₂ + 5-HT₂A 수용체 길항 또는 부분 작용제. • 음성 증상, 인지기능에도 일부 효과, EPS 적음. |
|
⚙️ 3세대 (부분 작용제 계열) • Aripiprazole, Brexpiprazole, Cariprazine • D₂ 부분 작용제, 5-HT₁A 작용제, 5-HT₂A 길항. • 안정적인 도파민 조절, 부작용 적음. |
| 대표 약물별 요약 |
|---|
|
⚙️ Haloperidol • D₂ 수용체 강력 길항 • 강력한 항정신병 효과, 급성기 조절에 유용 • ⚠️ EPS, 긴장증, 고프로락틴혈증, QT 연장 |
|
⚙️ Chlorpromazine
• D₂ + α₁ + H₁ + M 수용체 차단 • 진정, 항불안 효과 • ⚠️ 진정, 기립성 저혈압, 항콜린 부작용 |
|
⚙️ Risperidone • D₂ + 5-HT₂A 길항 • 양성·음성 증상 모두에 효과 • ⚠️ 고프로락틴혈증, EPS (고용량 시) |
|
⚙️ Olanzapine • D₂ + 5-HT₂A + H₁ 차단 • 음성 증상, 불안, 수면개선 • ⚠️ 체중 증가, 대사증후군 위험 높음 |
|
⚙️ Quetiapine • D₂ 약한 길항 + 5-HT₂A + H₁ + α₁ 차단 • 수면, 불안 완화, EPS적음 • ⚠️ 진정, 기립성 저혈압, 체중 증가 |
|
⚙️ Aripiprazole • D₂ 부분 작용제 • 대사 부작용 적음, 졸림 적음 • ⚠️ 불면, 초조, 초기에 불안감 가능 |
|
⚙️ Clozapine
• D₂ + 5-HT₂A + D₄ + M₁ + H₁ 길항 • 치료저항성 조현병(TRS)에 유일하게 유효 • ⚠️ 무과립구증(agranulocytosis), 체중증가, 경련 위험 |
|
⚙️ Ziprasidone • D₂ + 5-HT₂A + 5-HT₁A 작용제 • 체중 증가 적음 • ⚠️ QT 연장 가능 |
|
⚙️ Cariprazine • D₃/D₂ 부분 작용제 • 음성 증상에 상대적으로 효과적 • ⚠️ 불면, 초조 |
|
치료 단계별 접근 |
|---|
|
(1) 급성기 (Acute phase) • 망상, 환각, 혼란, 공격적 행동 등 양성 증상이 뚜렷할 때 • SGA 단독 요법이 1차 선택 (Risperidone, Olanzapine, Aripiprazole 등) • Clozapine: 두 가지 이상 약물에 반응 없을 때 사용 • Haloperidol IM / Olanzapine IM / Ziprasidone IM: 급성 흥분, 공격 시 응급 사용 |
|
(2) 안정화기 (Stabilization phase) • 증상 조절 후 유지 및 재발 예방 • 같은 약물 유지, 용량 서서히 감량 • 약물 순응도 저하 시 장기지속형 주사제(LAI) 고려 (예: Risperidone LAI, Paliperidone LAI Aripiprazole LAI) |
|
(3) 유지기 (Maintenance phase) • 첫 발병 후 최소 1~2년, 재발성 환자는 평생 유지요법 • 장기 부작용(체중, 대사, prolactin, 심전도 등) 정기 모니터링 필수 |
|
⚠️ 주요 부작용 및 관리 |
|---|
|
⚙️ 추체외로 증상 (EPS) • 원인 약물/기전: D₂ 차단 (특히 FGA, 고용량 Risperidone) • 주요 증상: 근긴장이상, 정좌불능, 파킨슨증 • 관리 방안: Benztropine, Biperiden 병용 |
|
⚙️ 지연성 운동장애(TD) • 원인 약물/기전: 장기 D₂ 차단 • 주요 증상: 입·혀·안면 반복운동 • 관리 방안: 용량 감량, 약물 교체, VMAT2 억제제(Valbenazine) |
|
⚙️ 대사증후군 • 원인 약물/기전: Olanzapine, Clozapine 등 • 주요 증상: 체중↑, 인슐린 저항성 • 관리 방안: 식이·운동·대사 모니터링 |
|
⚙️ 고프로락틴혈증 • 원인 약물/기전: Risperidone, Paliperidone • 주요 증상: 무월경, 유즙분비, 성기능 저하 • 관리 방안: Aripiprazole 전환 |
|
⚙️ 진정, 체중 증가 • 원인 약물/기전: H₁ 차단 (Clozapine, Olanzapine) • 주요 증상: 졸림, 식욕 증가 • 관리 방안: 용량 조절, 생활습관 개선 |
|
⚙️ 심혈관계 부작용 • 원인 약물/기전: QT 연장(Ziprasidone, Haloperidol 고용량) • 주요 증상: 부정맥 • 관리 방안: ECG 모니터링 |
|
⚙️ 무과립구증 • 원인 약물/기전: Clozapine • 주요 증상: 백혈구 수 감소 → 감염 위험 • 관리 방안: 정기 CBC 검사 (주 1회→월 1회) |
| 병용 요법 (Adjunctive therapy) |
|---|
|
⚙️ 병용약물: Benzodiazepine (Lorazepam등) • 사용목적: 급성 흥분, 불안 완화 • 비고: 단기 사용 |
|
⚙️ 병용약물: 기분조절제 (Valproate, Lithium) • 사용목적: 조현정동장애 또는 공격적 행동 • 비고: 병용 시 혈중농도 모니터링 |
|
⚙️ 병용약물: 항우울제 (SSRI) • 사용목적: 음성증상, 우울증 병발 시 • 비고: 세로토닌 증후군 주의 |
|
⚙️ 병용: 비타민 B, D, 오메가-3 등 영양보조 • 사용목적: 인지/음성증상 개선 보조 • 비고: 근거는 제한적 |
| 치료저항성 조현병 (TRS) |
|---|
|
• 두 가지 이상 항정신병약물(≥6주)에 충분히 반응하지 않을 때 TRS로 정의 • Clozapine이 유일한 근거 있는 치료 |
|
• Clozapine 무반응 시: - Aripiprazole, Cariprazine 병용 - 전기경련요법(ECT) 병합 - 인지행동치료 병행 고려 |
약물 복용 중단은 재발 위험을 높일 수 있으며 장기 지속형 주사제(예: 리스페리돈 콘스타, 팔리페리돈 팔미테이트)가 순응도 개선에 도움이 될 수 있다. 체중 증가, 대사 이상 등의 부작용은 식이 조절, 운동, 약물 변경으로 관리하여야 하며, 약 20-30% 환자는 표준 치료에 반응하지 않는 피료저항성이 나타난다. 이 경우 클로자핀 또는 전기경련요법(ECT)이 대안이 될 수 있다.
약물치료는 심리사회적 치료(인지행동치료, 가족 치료, 사회기술 훈련)와 병행해야 효과적이며, 영양 관리(예: 오메가-3, 비타민 D 보충)도 증상 완화에 도움을 줄 수 있다.
📚 References
Nechifor, M. Magnesium and Zinc in Schizophrenia. Biomedicines 2025, 13, 2249.
Barnard, Neal D., editor. "Schizophrenia." Nutrition Guide for Clinicians, 3rd ed., Physicians Committee for Responsible Medicine, 2025.
Onaolapo OJ, Onaolapo AY. Nutrition, nutritional deficiencies, and schizophrenia: An association worthy of constant reassessment. World J Clin Cases. 2021 Oct 6;9(28):8295-8311.
Scott Teasdale, Sabrina Mörkl, Annabel Sandra Müller-Stierlin, Nutritional psychiatry in the treatment of psychotic disorders: Current hypotheses and research challenges, Brain, Behavior, & Immunity - Health, Volume 5, 2020.
Arroll, M.A., Wilder, L. & Neil, J. Nutritional interventions for the adjunctive treatment of schizophrenia: a brief review. Nutr J 13, 91 (2014).
Cha HY, Yang SJ. Anti-Inflammatory Diets and Schizophrenia. Clin Nutr Res. 2020 Oct 28;9(4):241-257.
Joseph Firth, Rebekah Carney, Brendon Stubbs, Scott B Teasdale, Davy Vancampfort, Philip B Ward, Michael Berk, Jerome Sarris, Nutritional Deficiencies and Clinical Correlates in First-Episode Psychosis: A Systematic Review and Meta-analysis, Schizophrenia Bulletin, Volume 44, Issue 6, November 2018, Pages 1275–1292.
Yan, Y.; Zhou, D.; Chen, J. Navigating Nutritional Inequality in Schizophrenia: A Comprehensive Exploration of Diet, Genetics, and Holistic Management Across the Life Cycle. Nutrients 2024, 16, 3738.
Hany M, Rizvi A. Schizophrenia. [Updated 2024 Feb 23]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.