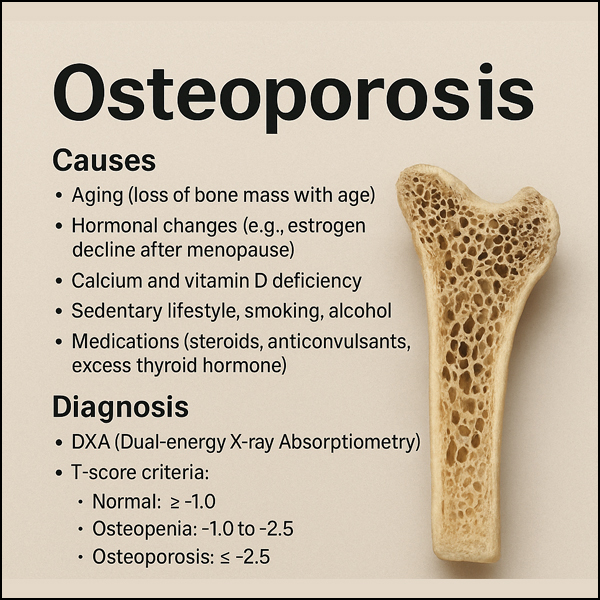
 골다공증
(osteoporosis)은 주로 골밀도(bone mineral density, BMD) 감소와 뼈 미세구조의 이상으로 뼈가 약해지고 쉽게 부러질 수 있는 상태를 말한다.
주로 노화, 호르몬 변화(특히 폐경 후 여성), 칼슘 및 비타민 D 부족, 유전적 요인, 특정 약물 사용 등으로 발생할 수 있다.
골다공증
(osteoporosis)은 주로 골밀도(bone mineral density, BMD) 감소와 뼈 미세구조의 이상으로 뼈가 약해지고 쉽게 부러질 수 있는 상태를 말한다.
주로 노화, 호르몬 변화(특히 폐경 후 여성), 칼슘 및 비타민 D 부족, 유전적 요인, 특정 약물 사용 등으로 발생할 수 있다.초기에는 증상이 없으나, 뼈가 약해지면서 골절(특히 고관절, 척추, 손목)이 쉽게 발생할 수 있으며, 허리 통증이나 키 감소, 척추 굽음(척추후만증) 등이 나타날 수 있다.
위험 요인은
1. 나이(50세 이상: 골형성 능력 저하)
2. 여성(특히 폐경 후 여성에서 에스트로겐 감소 → 뼈 흡수 증가)
3. 영양 부족(칼슘, 비타민 D 부족)
4. 가족력
5. 저체중 또는 마른 체형
6. 생활 습관(운동 부족, 흡연, 과음, 카페인)
7. 약물: 스테로이드, 항경련제, 갑상선호르몬 과다 복용 등
등이다.
글루코코르티코이드(Glucocorticoid, GC)는 염증성 질환 치료에 흔히 사용되지만, 장기 사용 시 골다공증을 유발한다. GC는 골 형성 세포(조골세포)의 활성을 억제하고, 파골세포의 활성을 증가시켜 뼈 손실을 초래하며, 칼슘 흡수를 감소시키고 뼈의 기질 단백질 합성을 억제하여 뼈 강도를 약화시킨다. 에스트로겐 결핍과 GC 과다 사용은 골 전환 균형을 무너뜨려 골다공증을 유발하는 주요 원인이며, 이들 호르몬 불균형의 기전을 이해하는 것은 골다공증 예방 및 치료 전략 개발에 중요하다.
골다공증의 진단은 주로 이중에너지 X선 흡수계측법(DXA, DEXA scan)을 이용한다.
DXA(Dual-Energy X-ray Absorptiometry)는 뼈 밀도(Bone Mineral Density, BMD)를 측정하는 표준 진단 기술로, 주로 골다공증 진단과 골절 위험 평가에 사용된다. BMD는 g/cm² 단위의 뼈 밀도 측정치이며, T-score는 젊은 성인(보통20~30세)의 평균 BMD와 비교한 표준편차로서 평가한다. 한편, Z-score는 연령 및 성별 맞춤 BMD 비교로, 2차 골다공증(예: 과갑상선기능항진증) 의심 시 활용된다.
이중에너지 X선 흡수계측법(DXA, DEXA scan) 골밀도 검사의 WHO 기준은 T-score 를 기준으로
1. -1.0 이상: 정상
2. -1.0 ~ -2.5: 골감소증
3. -2.5 이하: 골다공증
과 같이 진단한다.
골다공증의 치료 및 예방은
1. 칼슘(1,000~1,200mg/일)과 비타민 D(800~1,000IU/일) 섭취: 개인별로 비타민D 섭취량 증가 필요.
2. 체중 부하 운동(걷기,계단 오르기, 러닝, 근력 운동)
3. 약물 치료(비스포스포네이트, 호르몬 요법 등)
4. 흡연 중단, 음주 제한
등이 대표적이다.
골다공증의 치료 목표는 주요 골절(척추, 고관절, 비고관절 골절)을 예방하는 것이 핵심이며, 골밀도 유지 및 증가[BMD(Bone Mineral Density) 향상], 통증 관리와 낙상 예방을 통해 기능적 독립성 유지를 통한 삶의 질을 향상시키는 것이다. 또한, 환자의 나이, 골절 위험(FRAX 도구 사용), 동반 질환 등을 고려한 맞춤 치료가 필요하다.
약물 선택은 골절 위험도에 따라 결정되는데 대부분의 환자에서 항흡수제(anti-resorptive) 또는 골형성제(anabolic agents)를 우선 고려하며, FRAX(fracture risk assessment tool) 점수 ≥20% 또는 기존 골절 시 치료를 시작하는 것이 권고된다.
| 골다공증 약물 치료 |
|---|
|
1. 항흡수제 (Anti-resorptive Agents): ☑︎ 비스포스포네이트 (Bisphosphonates, BPs): • 작용기전: 하이드록시아파타이트(hydroxyapatite)에 결합하여 파골세포(osteoclast)의 활동을 억제(골흡수 억제). • Nitrogen-containing bisphosphonates: - alendronate, risedronate, ibandronate, pamidronate, zoledronic acid. - 메발로네이트 경로 억제로 파골세포 사멸 유도. • Non-nitrogen-containing bisphosphonates: - etidronate, clodronate, tiludronate. - 덜 강력, 세포 독성 대사물 생성. • 효능: - 골다공증: 척추 골절 40-70%, 고관절 골절 20-50% 감소(RCT 데이터). - 파제트병: 뼈 통증 감소, 뼈 리모델링 정상화. - 악성종양: 골 관련 합병증(Skeletal Related Events, SREs) 30-40% 감소. - 장기 사용(3-5년)으로 BMD 증가 지속. • 결과: 골흡수 감소, 골형성 유지, 골절 위험 감소. • 적응증: - 골다공증: 폐경 후 여성, 남성, 글루코코르티코이드 유발 골다공증. - 파제트병: 비정상적 뼈 리모델링 억제. - 악성종양: 골전이, 다발성골수종, 고칼슘혈증. - 기타: 골형성부전증, 섬유성 이형성증. • 투여: - 경구: 알렌드로네이트(주 1회 70mg), 리세드로네이트(주 1회 35mg), 이반드로네이트(월 1회 150mg). 아침 공복 시 물 180-240mL와 함께, 최소 30분간 똑바로 앉거나 서 있음. - 정맥(IV): 졸레드로네이트(연 1회 5mg), 이반드로네이트(3개월마다 3mg). 순응도 높음, 위장 부작용 적음. - 흡수율: 경구 BPs는 흡수율 낮음(<1%), 식사/음료(특히 칼슘)와 함께 복용 시 흡수 저하. ⚠️ 부작용 - 경구 약물: 식도염, 위장 장애(5-10%), 복용 지침 준수 시 최소화. - 정맥 약물: 급성기 반응(발열, 근육통, 20-40%, 첫 투여 시 흔함), 저칼슘혈증. - 희귀 부작용:턱골괴사(Osteonecrosis of the Jaw, ONJ) 발생률 0.001-0.1%, 주로 고용량 IV 투여(악성종양 환자)에서. - 비전형 대퇴골 골절: 장기 사용(>5년) 시 발생률 0.01-0.02%. - 심방세동: 졸레드로네이트 관련 논란, 명확한 인과관계 미확립. - 관리: 투여 전 치과 검진, 칼슘/비타민 D 보충, 정기 모니터링. 🚫 주의사항 및 금기: - 금기: 저칼슘혈증, 신부전(CrCl <35 mL/min, 일부 약물), 식도 협착/운동 이상. - 약물 상호작용: 칼슘 보충제, 제산제는 흡수 방해, 투여 시간 분리 필요. - 특수 집단:임신/수유: 금기(카테고리 C/D). - 신부전 환자: 졸레드로네이트 피하고, 이반드로네이트 조정. - 고령자: 안전, 하지만 부작용 모니터링 강화. 🔹 장기 사용 및 약물 휴식(Drug Holiday)기간: - 골다공증은 3-5년 사용 후 재평가. - 약물 휴식: 저위험 환자에서 가능(알렌드로네이트/졸레드로네이트는 잔류 효과 1-2년 지속). 고위험 환자는 지속 치료 권장. - 재시작 기준: BMD 감소, 골절 위험 증가(FRAX 점수). 🔹 모니터링: - 검사: 치료 전/후 BMD(DEXA), 혈청 칼슘, 25-OH 비타민 D, 신장 기능. - 빈도: 1-2년마다 BMD 재검사, 부작용 정기 확인. - 마커: 뼈 전환 마커[CTX((C-telopeptide of collagen type 1), P1NP]로 치료 반응 평가(선택적). 🔹 임상적 중요성: - BPs는 비용-효과적이며, 골다공증 및 기타 뼈 질환에서 1차 치료제로 널리 사용. - 환자 교육 중요: 복용 지침 준수, 부작용 인지, 생활 습관 개선(칼슘/비타민 D 섭취, 운동). - 데이터(2023): ONJ/비전형 골절 위험 관리 가이드라인 강화, 개인화 치료 강조. ☑︎ RANKL(Receptor Activator of Nuclear Factor-kappaB Ligand) 억제제(파골세포 억제): • 데노수맙 (Denosumab): - 효능: 모든 주요 골절 위험 68% 감소. - 폐경 후 여성: 단회 60mg denosumab 투여 시 뼈 흡수 마커 85% 감소, BMD 3-6% 증가 (FREEDOM 시험 초기 데이터). - 남성 골다공증: 유사한 BMD 향상. - 파제트병: 뼈 리모델링 정상화, 통증 감소. - 기타: 글루코코르티코이드 유발 골다공증, 섬유성 이형성증(fibrous dysplasia)에서 잠재적 이점. - ⚠️ 흔한 부작용: 피로, 근육통, 두통, 저칼슘혈증 (특히 투여 초기). - ⚠️ 심각한 부작용: 턱뼈 괴사(ONJ: Osteonecrosis of the Jaw); 🚫 치과 시술 전 중단 권고, 비정형 대퇴골 골절 (Atypical Femoral Fracture), 심각한 감염 (세포 면역 억제 관련), 저칼슘혈증, 피부 반응 (발진, 습진) 등. - ⚠️ 장기 사용(>3년): 골절 위험 증가 가능성 모니터링 필요. - ⚠️ 중단 시 반동 골절 위험. - 🚫 금기: 저칼슘혈증, Prolia®의 경우 임신/수유부, Xgeva®의 경우 과민반응. - ⚠️ 주의: 신부전(크레아티닌 청소율 <30mL/min) 환자에서 저칼슘혈증 위험 ↑; 치과 건강 관리 필수. - ⚠️ 약물 상호작용: 다른 뼈 흡수 억제제(비스포스포네이트)와 병용 시 ONJ 위험 증가. - 🔬 모니터링 (Monitoring): 골밀도(DXA 스캔)(매 1-2년), 혈청 칼슘, 인, 비타민 D 수준을 투여 전후 정기 검사, 뼈 흡수 마커(CTX)로 효과 평가, 치과 검사는 매년 또는 시술 전 필요. ☑︎ 호르몬 요법 (Hormone Replacement Therapy, HRT): 🔹 폐경기 여성 대상 에스트로겐: • 효능: - 폐경 후 5-10년 내 사용 시 척추 및 고관절 골절 위험 30-50% 감소(Women’s Health Initiative, WHI 시험). - DXA로 측정한 T-score 개선. ⚠️ 부작용 및 제한: - 위험: 유방암, 자궁내막암(프로게스틴 미사용 시), 혈전증, 심혈관 질환 위험 증가(WHI 데이터). - 제한: 60세 이상 또는 폐경 후 10년 이상 지난 여성에겐 권장되지 않음(위험 > 이익). - 장기 사용 시 부작용 우려로 비스포스포네이트나 Denosumab이 선호됨. 🔹 테스토스테론 (남성 골다공증): • 대상: 저테스토스테론증(hypogonadism) 관련 남성 골다공증. • 기전: 테스토스테론은 에스트로겐으로 전환되어 RANKL 억제, 골모세포 활성화. • 투여: 패치, 젤, 주사. • 효과: BMD 증가(3-5%), 골절 데이터 제한적. • 한계: 전립선암, 심혈관 위험 증가로 제한적 사용. ☑︎ SERM(selective estrogen receptor modulator): 🔹 Raloxifene: • 에스트로겐 대체 요법(HRT)의 대안 • 뼈에서 에스트로겐 유사 효과를 발휘해 골 흡수 억제 및 골 밀도 유지에 기여하며, 특히 RANKL/RANK 경로 억제를 통해 파골세포 활성을 감소. • HRT와 비교해 유방암 및 자궁내막암 위험이 낮아 안전성이 강조되지만, 골 보호 효과는 에스트로겐보다 약간 덜 강력 • 효능: 척추 골절 30-50% 감소. • 용도: - 폐경 후 골다공증 치료 및 예방. - 에스트로겐 수용체 양성(ER+) 유방암 위험 감소. • 투여: 경구 복용(일반적으로 60mg/일, Evista). ⚠️ 안전성: - 뇌졸중 위험 증가. 정맥 혈전증, 안면 홍조, 다리 경련 등. - 특히 심혈관 질환 위험이 높은 고령 여성에서 Raloxifene 사용 시 주의가 필요. |
|
2. 골형성제 (Anabolic Agents): ☑︎ 부갑상선호르몬(PTH) 유사체: 🔹 Teriparatide: • 작용기전: - Teriparatide는 부갑상선호르몬(PTH)의 1-34 아미노산 서열로 구성된 재조합 단백질. - 간헐적 투여 시(하루 1회 피하 주사), 조골세포(골 형성 세포) 활성을 자극하여 뼈 형성을 촉진하고, 골 흡수보다 골 형성을 우선시 함. - 주요 작용 경로: RANKL/OPG 경로 조절과 Wnt/β-catenin 신호전달 활성화를 통해 뼈 질량과 강도를 증가. - PTH(Parathyroid Hormone)는 저용량 단속 투여 시 골형성 촉진(골모세포 활성화) 및 간접적으로 RANKL/OPG 경로 조절. - 뼈 흡수 억제제가 아닌 동화작용제(anabolic agent)로, BMD를 크게 증가시킴. • 효능: - 척추 BMD 9-13% 증가, 골절 위험 65-70% 감소(Fracture Prevention Trial). 고관절 골절 50% 감소. - 고위험 골다공증 환자(기존 골절, T-score ≤ -3.0)에서 1차 선택. • 적응증: - 폐경 후 여성의 골다공증: 골절 위험이 높은 경우. - 남성의 원발성 또는 저성선기능성 골다공증: 골절 위험이 높은 경우. - 글루코코르티코이드 유발 골다공증: 장기 스테로이드 사용으로 인한 뼈 손실 치료. - FDA 승인: 골밀도 감소가 심하거나 기존 치료(예: 비스포스포네이트)에 반응하지 않는 고위험 환자에게 사용. • 투여 방법: - 용량: 1일 1회 20μg 피하 주사(복부 또는 허벅지). - 치료 기간: 일반적으로 2년 이하로 제한(골육종 위험 증가로 인해 장기 사용 금지). - 투여 후 칼슘과 비타민 D 보충을 권장. 🏥 임상적 고려사항: - Teriparatide는 동화작용(anabolic) 약물로, 골 흡수를 억제하는 비스포스포네이트와 달리 뼈 형성을 직접 촉진. - 비스포스포네이트 실패 사례나 고위험 환자에게 우선 사용. - 치료 후 비스포스포네이트 또는 데노수맙으로 전환하여 골밀도 유지 효과를 강화할 수 있음. - 비용이 높아 경제적 부담이 문제. ⚠️ 부작용: - 흔한 부작용: 주사 부위 통증, 메스꺼움, 두통, 어지럼증, 다리 경련. - 심각한 부작용:고칼슘혈증(hypercalcemia)(투여 후 일시적 혈중 칼슘 증가). - 골육종(osteosarcoma): 쥐 실험에서 고용량 장기 투여 시 관찰되었으나, 인간에서의 위험은 드묾. ⚠️ 주의사항: - 🚫 골육종 병력, 파제트병, 뼈 전이, 또는 방사선 치료 병력이 있는 환자는 사용 금지. - 🚫 젊은 환자(성장판 미폐쇄)나 임신/수유 여성에게 사용 금지. - 신부전, 고칼슘혈증, 또는 뼈 대사 질환 환자에게 주의. - 환자 교육(자가 주사 방법, 부작용 관리)이 중요. 🔹 Abaloparatide • 약리학 및 작용 기전: - Abaloparatide는 PTHrP(1-34)의 합성 아날로그로, PTH 1형 수용체(PTHR1)의 RG 컨포메이션에 선택적으로 결합. - 간헐적 투여 시 조골세포(골 형성 세포)를 자극하여 뼈 형성을 우선적으로 촉진하고, 골 흡수를 최소화(Wnt/β-catenin 경로 활성화와 RANKL/OPG 균형 조절을 통해 이루어짐). - Teriparatide(PTH 1-34)와 달리 더 일시적인 신호 전달로 골 형성 효과가 우수하며, 고칼슘혈증 위험이 감소. • 효능: - ACTIVE 시험 (n=1,904, 폐경 후 여성): Abaloparatide는 플라시보 대비 새로운 척추 골절 위험 86% 감소, 비척추 골절 43% 감소. 골밀도(BMD) 증가 (요추 11.2%, 고관절 5.3%). - ACTIVE 비교 시험: Teriparatide 대비 골밀도 증가가 우수 (전체 BMD 향상 우월성). - 남성 대상 ATOM 연구: BMD 증가 확인, 골절 감소 효과는 추가 연구 필요. - P1NP(Procollagen type 1 N-terminal propeptide) 같은 골 형성 마커 상승. • 적응증: - 폐경 후 여성의 골다공증: 골밀도 감소가 심하거나 골절 위험이 높은 경우 (T-score ≤ -2.5, 또는 다발성 골절 병력). - 남성의 골다공증: 2022년 FDA 승인으로 고위험 남성 환자에 사용 (ATOM 및 ACTIVE-J 연구 기반). - 다른 치료(비스포스포네이트 등)에 실패한 고위험 환자. - 골다공증 예방 및 치료, 특히 척추/비척추 골절 위험 감소. 🏥 임상적 고려사항: - 고위험 골다공증 환자(예: T-score < -3.5 또는 다발 골절)에서 Teriparatide나 romosozumab과 함께 1차 선택. - 비용이 높아 경제적 접근성 문제; 자가 주사 교육 필수. - 🚫 금기: 골육종/전이성 뼈 종양 병력, 파제트병, 고칼슘혈증, 신부전, 임신/수유 여성. - 중단 시 뼈 손실 방지를 위해 항흡수제(anti-resorptive)로 전환 권장. • 투여 방법: - 용량: 1일 1회 80μg 피하 주사(복부 또는 허벅지, Tymlos® 펜으로 자가 주사). - 치료 기간: 최대 18-24개월로 제한 (장기 사용 시 골육종 위험 증가로 인해). - 칼슘과 비타민 D 보충 병행 권장. 치료 후 비스포스포네이트나 데노수맙으로 전환하여 골밀도 유지. ⚠️ 부작용: - 흔한 부작용: 주사 부위 통증/발적 (70%), 메스꺼움, 두통, 어지럼증, 다리 경련, 피로. - 심각한 부작용:고칼슘혈증(hypercalcemia): 일시적 증가 (발생률 6-11%), 모니터링 필요. - 골육종(osteosarcoma): 쥐 모델에서 고용량 장기 투여 시 관찰; 인간 위험 낮으나 병력 있는 환자 금지. - 심혈관계: 저혈압이나 빈맥 가능; 심혈관 질환 환자 주의. - 기타: 요로결석, 신장 결석 위험 증가. - 부작용 발생률은 Teriparatide와 유사하나, 고칼슘혈증은 상대적으로 낮음. ☑︎ Sclerostin inhibitor: 🔹 Romosozumab(상품명: Evenity): • Romosozumab(항-sclerostin 항체)은 sclerostin을 직접 억제하여 Wnt 경로를 활성화하고 뼈 형성을 강력히 촉진 • 약리학 및 작용 기전: - Romosozumab은 SOST 유전자에서 발현되는 sclerostin 단백질에 결합하여 Wnt/β-catenin 신호전달 경로를 활성화. - Sclerostin 억제는 조골세포(골 형성 세포) 활성을 증가시키고, RANKL 발현을 줄여 파골세포(골 흡수 세포) 활성을 억제. - 이중 효과(골 형성 증가 + 골 흡수 감소)로 골밀도(BMD)를 빠르게 증가시키며, 뼈 구조를 강화. - 약물 반감기는 약 12.8일이며, 피하 주사로 투여. • 효능: 척추 골절 73% 감소. • 적응증: - 폐경 후 여성의 골다공증: 골절 위험이 높은 경우 (T-score ≤ -2.5, 또는 다발성 골절 병력). - 남성의 골다공증: 2022년 FDA 승인으로 고위험 남성 환자에 사용 (BRIDGE 시험 기반). - 비스포스포네이트 등 기존 치료에 반응하지 않거나 고위험 환자에게 적합. ⚠️ 안전성: - Sclerostin 억제제(예: Romosozumab)는 장기 안전성 데이터가 제한적이며, 골육종 위험(동물 모델)과 심혈관 사건이 우려됨. - 치료 기간은 일반적으로 1-2년으로 제한되며, 이후 항흡수제(예: 비스포스포네이트, 데노수맙)로 전환하여 뼈 손실을 방지. - 심혈관 사건 위험으로 고위험 환자 주의. • 투여 방법: - 용량: 1개월에 1회 210mg (105mg 주사 2회) 피하 주사. - 치료 기간: 최대 12개월로 제한 (심혈관 위험 및 장기 안전성 우려로). - 치료 후 비스포스포네이트 또는 데노수맙으로 전환하여 골밀도 유지 권장. - 칼슘과 비타민 D 보충 병행. |
|
3. Calcitonin: • 갑상선의 C세포에서 분비되는 펩타이드 호르몬 • 혈중 칼슘 농도가 높아질 때 분비되어 칼슘 농도를 낮춤. • 파골세포 억제: 파골세포의 뼈 흡수 활동을 억제하여 뼈에서 칼슘 방출을 줄임. • 뼈 리모델링 과정에서 파골세포의 과활성화를 억제하여 뼈 손실을 방지. • 신장에서 칼슘과 인의 재흡수를 감소시켜 혈중 칼슘 농도를 낮춤. • 통증 완화용, 효능 제한적: - 골다공증:폐경 후 골다공증 치료에 사용, 특히 척추 골절 위험 감소. - 비스포스포네이트나 Denosumab에 비해 효과는 약하며, 주로 초기 치료나 대체 요법으로 사용. - 투여 경로: 비강 스프레이(Miacalcin®) 또는 피하/근육 주사. - 파제트병(Paget’s Disease):비정상적인 뼈 리모델링 억제 및 뼈 통증 완화. - 고칼슘혈증(Hypercalcemia):원발성 과갑상선기능항진증 등으로 인한 급성 고칼슘혈증 관리. - 골전이 통증: 암 관련 뼈 통증 완화에 보조적으로 사용. ⚠️ 부작용: - 비강 자극, 메스꺼움, 안면 홍조, 드물게 알레르기 반응. - 장기 사용 시 효과 감소(타키필락시스, tachyphylaxis) 가능. - 안전성 우려: 장기 사용 시 미미한 암 위험(2013년 EMA 경고)으로 비강 칼시토닌 사용 제한. |
|
4. 치료 기간 및 중단 • 초기: 3-5년 (비스포스포네이트 기준). • 장기 관리: "약물 휴식 기간(drug holiday)" 고려 – 저위험 환자에서 1-3년 후 재평가. BMD 안정 시 휴식 가능. ⚠️ 중단 위험: 항흡수제 중단 시 골밀도 손실 가속 (특히 데노수맙). |
|
5. 모니터링 및 추적 관찰 • BMD 검사: 치료 시작 전, 1-2년 후 재검사. • 재평가: 매년 FRAX 및 임상 평가. ⚠️ 부작용 모니터링: 신장 기능, 칼슘 수준, 골절 발생. |
|
6. 특수 집단 (Special Populations)고위험군: • 기존 골절, 다중 위험 요인 환자 – 즉시 강력 약물(예: 골형성제) 시작. • 남성 및 젊은 환자: 유사 가이드라인 적용, 테스토스테론 검사. ⚠️ 신장/간 질환자: 용량 조정 필요 (예: 졸레드로네이트 피함). ⚠️ 장기 입원 시 골절 위험 증가, 조기 개입 추천. |
|
7. IOF 권고: • 글로벌 합의 문서(Global Consensus)를 통해 국가별 가이드라인 조화를 강조. • AI 기반 위험 예측 도입 제안. • 강조점: 다학제 팀 접근(의사, 간호사, 영양사)과 환자 교육. |
비스포스포네이트는 골다공증, 골형성부전증, 파제트병, 악성종양 관련 고칼슘혈증 등 뼈 질환 치료에 널리 사용되는 약물군으로서 뼈 흡수를 억제하여 골밀도(BMD)를 유지/증가시키고 골절 위험을 감소시킨다. 그러나 부작용(특히 ONJ, 비전형 골절)과 복용 순응도를 고려한 적절한 관리와 모니터링이 필수이며 환자별 위험-이익 평가를 통해 치료를 최적화해야 한다.
턱골괴사(ONJ)는 비스포스포네이트(BPs) 또는 기타 항흡수제(예: 데노수맙) 사용과 관련된 드문 부작용으로, 턱뼈의 괴사(조직 사멸)가 특징이다. ONJ는 턱뼈(상악 또는 하악)의 노출된 뼈가 8주 이상 지속되며, 방사선 요법 병력이 없고 감염, 염증, 또는 치유되지 않는 상처로 나타나는 상태이다. 주로 치과 처치(발치, 임플란트) 또는 턱뼈 외상 후 발생한다.
ONJ는 비스포스포네이트(특히 정맥 투여, 예: 졸레드로네이트, 파미드로네이트)와 데노수맙 사용, 그리고 고용량, 장기 사용(특히 악성종양 치료 시)에서 위험성이 증가한다. 골다공증 환자(저용량 경구 BPs)에서 0.001-0.01% (매우 드묾), 악성종양 환자(고용량 IV BPs)에서 1-10% 정도 발생하는 것으로 알려져 있다.
ONJ의 기타 위험 요인으로서는 치과 수술(발치, 임플란트) 또는 치주 질환, 흡연, 당뇨병, 스테로이드 사용, 면역 억제 상태, 구강 위생 불량, 턱뼈 감염 등이다.
ONJ의 증상은 턱뼈 노출(보통 잇몸에서 뼈가 보임)., 지속적인 턱 통증, 부종, 고름 배출, 치유되지 않는 발치 부위. 심한 경우, 턱뼈 골절 또는 심각한 감염 등이다.
ONJ의 경우 임상적으로 노출된 뼈, 염증, 감염 징후 등을 확인하고, X-ray, CT, MRI로 뼈 손상 확인하며, 병력 상 비스포스포네이트 사용 기간, 투여 경로, 치과 치료 병력 등을 확인하여 진단한다. 치료 상 보존적 관리요법으로 항생제, 구강 세척제, 통증 관리 등이 필요하고, 심한 경우에는 괴사 조직 제거 또는 턱뼈 재건술 등을 시행한다. 또한, ONJ 발생 시 BPs 중단을 검토(전문의 판단)하여야 한다. ONJ는 비스포스포네이트 사용과 관련된 희귀 부작용으로, 치과 관리와 예방적 조치로 위험을 최소화할 수 있다. 골다공증 치료에서 BPs의 안전성과 효능은 여전히 높게 평가되며, ONJ 위험은 적절한 관리로 통제가 가능하다.
파골세포(Osteoclast)는 뼈의 리모델링(재형성: 신체의 성장, 운동, 부상 회복 시 뼈 구조를 재조정) 과정에서 핵심적인 역할을 하는 세포로, 뼈를 분해하고 흡수하는 기능을 한다. 뼈는 일생 동안 지속적으로 생성과 소멸을 반복하는데, 파골세포는 오래된 뼈나 손상된 뼈를 녹여 칼슘을 혈액으로 방출하거나 새로운 뼈 형성을 위한 공간을 만든다(혈액 내 칼슘이 부족할 때 뼈에서 칼슘을 추출하거나, 미세 균열이 생긴 뼈를 제거). 이는 골모세포(osteoblast, 뼈를 만드는 세포)와 균형을 이루어 뼈의 건강을 유지하는 데 필수적이다.
RANKL은 파골세포 전구세포 표면의 RANK(Receptor Activator of NF-κB)에 결합하여 분화, 생존, 융합을 촉진하고, 성숙 파골세포를 활성화하며 아폽토시스(apoptosis)를 억제한다. OPG(Osteoprotegerin)가 RANKL의 중화 decoy 수용체로 작용하여 효과를 상쇄한다.
Decoy 수용체는 리간드(신호 분자)와 결합하여 해당 리간드가 본래의 기능적 수용체와 상호작용하지 못하도록 막는 비신호전달 수용체이다. OPG는 RANKL의 대표적인 decoy 수용체로, RANKL이 파골세포의 RANK 수용체에 결합하는 것을 경쟁적으로 억제하여 파골세포의 분화와 활성화를 차단한다. OPG는 골모세포와 기타 세포에서 분비되며, RANKL-RANK 신호전달을 억제하여 뼈 흡수를 조절한다.
RANKL/OPG 균형 불균형은 골다공증, 파제트병(Paget's disease), 원발성 과갑상선기능항진증(primary hyperparathyroidism) 등 양성 대사성 골질환의 병인에 관여한다. 기존 치료(비스포스포네이트, 호르몬 요법 등)는 부분적으로 RANKL/OPG 경로를 수정하지만, 직접적 RANKL 억제는 더 특이적이고 강력한 접근으로 알려져 있다. RANKL 억제제의 주요 약물은 Denosumab(인간 단클론 항체, RANKL에 고친화력 결합)이며, OPG-Fc 융합 단백질(초기 후보)도 언급된다. Denosumab은 OPG의 decoy 수용체 역할을 모방하는 인공적인 접근법으로, RANKL을 직접 중화하여 파골세포 활동을 억제한다. RANKL 억제제 기전은 RANKL을 직접 중화하여 파골세포 활동을 급속히 억제, 뼈 흡수 마커(CTX, NTX 등)를 빠르게 감소시키는 것이다. 효과는 단회 피하 주사 후 수개월간 지속되며, 비스포스포네이트 대비 더 강력한 뼈 흡수 억제(70-90% 감소), 경구 복용 불필요, 적은 신장 독성 등이 장점이다.
칼시토닌은 갑상선의 C세포(부갑상선 세포와 구별되는 세포)에서 분비되는 펩타이드 호르몬으로, 뼈 대사와 칼슘 항상성 유지에 중요한 역할을 한다. OPG(자연적 RANKL decoy 수용체)와 달리, 칼시토닌은 호르몬으로 작용하며 파골세포의 세포 내 신호전달을 직접 조절한다. 칼시토닌은 주로 합성 형태(연어 칼시토닌, salmon calcitonin)로 의약품으로 사용된다.
칼시토닌은 RANKL/OPG 경로에 간접적으로 영향을 미치는데, 파골세포의 RANKL-RANK 신호전달을 억제하여 뼈 흡수를 줄인다. 그러나 Denosumab(직접적인 RANKL 억제제)보다 특이성이 낮고, 효과도 약하다. 칼시토닌은 Denosumab(강력한 RANKL 억제제)이나 비스포스포네이트가 주로 사용되는 현대 골다공증 치료에서 2차 선택으로 간주된다. 주로 단기 치료(고칼슘혈증, 파제트병 통증)나 다른 약물에 반응하지 않는 환자에게 사용하며, DXA(BMD, T-score)로 치료 효과 모니터링이 가능하지만 칼시토닌은 BMD 증가 효과가 미미하다.
호르몬 요법은 주로 에스트로겐(여성의 경우) 또는 테스토스테론(남성의 경우)과 같은 성호르몬, 또는 칼시토닌과 같은 뼈 대사 조절 호르몬을 사용하여 골다공증을 관리한다. 폐경 후 여성의 골다공증에서 에스트로겐 요법이 가장 일반적이며, 이는 폐경으로 인한 에스트로겐 감소가 뼈 흡수를 가속화하기 때문이다.
에스트로겐 결핍은 염증성 사이토카인(예: IL-6, TNF-α) 증가를 유도하여 골 흡수 세포(파골세포)의 활성을 촉진하며, 에스트로겐은 RANKL 발현을 억제하고 OPG 발현을 증가시켜 파골세포 활동을 감소시킨다. 또한, 에스트로겐은 골모세포(뼈 형성 세포)의 생존을 촉진하고 뼈 리모델링 균형 유지에 기여하며, 그 결과로 뼈 흡수 감소, BMD 증가(척추 5-10%, 고관절 2-5%)를 나타낸다.
한편, 장기 사용 시 유방암, 자궁내막암(프로게스틴 미사용 시), 혈전증, 심혈관 질환 위험 증가 등의 부작용 우려로 비스포스포네이트나 Denosumab이 선호되며, 1차 치료제(Denosumab, 비스포스포네이트)보다 덜 사용된다. 폐경 초기 여성(50-59세)에서 단기 사용 또는 열성 홍조 같은 폐경 증상 동반 시 고려할 수 있다.
테스토스테론은 아로마타제(aromatase) 효소에 의해 에스트로겐(주로 에스트라디올)으로 전환된다. 이 과정은 남성의 뼈 건강에서 중요한 역할을 한다. 남성의 골다공증에서 테스토스테론 요법은 직접적으로(안드로겐 수용체를 통해) 또는 간접적으로(에스트로겐으로 전환되어) 뼈 대사에 영향을 미친다.
에스트로겐으로 전환된 테스토스테론은 RANKL 발현을 억제하고, OPG 발현을 증가시킨다. 이는 파골세포(osteoclast)의 분화와 활성을 감소시켜 뼈 흡수를 억제한다. 결과적으로, 뼈 리모델링 과정에서 뼈 손실이 줄어들고 골밀도(BMD)가 유지되거나 증가한다.
테스토스테론은 안드로겐 수용체를 통해 골모세포(osteoblast)의 증식과 생존을 촉진하여 뼈 형성을 증가시키며, 에스트로겐으로 전환된 후에도 에스트로겐 수용체(ER)를 통해 골모세포 활성을 강화하며, 뼈 기질 합성을 촉진한다. 임상적으로 테스토스테론 요법은 저테스토스테론증(hypogonadism)이 있는 남성의 골다공증 치료에서 BMD를 약 3-5% 증가시키고, DXA로 측정한 T-score를 개선한다. 골절 위험 감소에 대한 데이터는 제한적이나, 척추 및 고관절 BMD 개선이 관찰되는 것으로 알려져 있다.
Raloxifene은 선택적 에스트로겐 수용체 조절제(SERM)로, 폐경 후 골다공증 치료에서 에스트로겐 대체 요법(HRT)의 대안이 될 수 있다. 뼈에서 에스트로겐 유사 효과를 발휘해 골 흡수 억제 및 골 밀도 유지에 기여하며, 특히 RANKL/RANK 경로 억제를 통해 파골세포 활성을 감소시킨다. HRT와 비교해 유방암 및 자궁내막암 위험이 낮아 안전성이 강조되지만, 골 보호 효과는 에스트로겐보다 약간 덜 강력하다.
Raloxifene은 골다공증과 유방암 위험 감소에 유익하지만, 치명적 뇌졸중 위험 증가로 인해 고위험군 환자에서 사용 시 신중해야 한다. Raloxifene은 에스트로겐과 유사하게 혈액 응고 경로에 영향을 미쳐 정맥 혈전증(venous thromboembolism, VTE) 및 잠재적으로 동맥성 혈전(예: 뇌졸중)을 증가시킬 수 있다. 이는 에스트로겐 수용체를 통한 응고 인자 활성화와 관련이 있다.
또한, Raloxifene은 특정 조직에서 에스트로겐 유사 작용을 하지만, 심혈관계에서는 보호 효과가 미미하거나 역효과를 낼 수 있다. 특히, 심혈관 질환 위험이 높은 고령 여성에서 혈관 내피 기능에 부정적 영향을 줄 가능성이 제기된다..
따라서, 환자와의 상담을 통해 위험-이익 균형을 논의하고, 대체 치료제(예: 비스포스포네이트)를 고려할 수 있다.
Teriparatide는 부갑상선호르몬(PTH)의 1-34 아미노산 서열로 구성된 재조합 단백질로서 골다공증 치료에 사용되는 합성 부갑상선호르몬(PTH) 유사체로, 뼈 형성을 촉진하여 골절 위험을 줄이는 약물이다. 간헐적 투여 시(하루 1회 피하 주사), 조골세포(골 형성 세포) 활성을 자극하여 뼈 형성을 촉진하고, 골 흡수보다 골 형성을 우선시한다. 주요 작용 경로는 RANKL/OPG 경로 조절과 Wnt/β-catenin 신호전달 활성화를 통해 뼈 질량과 강도를 증가시키며, 특히 해면골(trabecular bone)에서 효과적이다.
Teriparatide는 고위험 골다공증 환자의 골절 예방에 효과적인 동화작용 치료제다. 부작용(고칼슘혈증, 골육종 위험)과 2년 사용 제한으로 인해 신중한 환자 선택과 모니터링이 필요하며, 골다공증 관리에서 다른 약물(비스포스포네이트, 데노수맙)과의 병행 또는 순차적 사용이 효과를 극대화한다.
Abaloparatide는 골다공증 치료를 위한 합성 펩타이드로, 부갑상선호르몬 관련 단백질(PTHrP)의 아날로그이며, Teriparatide와 같이 뼈 형성을 촉진하여 골절 위험을 줄이는 동화작용(anabolic) 약물로, 특히 고위험 환자에게 사용되며, 특히 폐경 후 여성과 고위험 남성에서 골절 예방에 우수한 것으로 알려져 있다. Teriparatide 대비 안전성(고칼슘혈증 감소)이 장점이나, 장기 안전성과 비용 효과 연구가 추가로 필요하다.
Sclerostin은 SOST 유전자에 의해 발현되는 단백질로, 주로 골세포(osteocyte)에서 분비된다. Wnt/β-catenin 신호전달 경로를 억제하여 조골세포(골 형성 세포)의 활성과 분화를 감소시킨다. 이는 뼈 형성을 억제하고 골 전환(bone turnover)을 조절하는 핵심 메커니즘이다. Sclerostin은 뼈의 기계적 부하에 반응하여 발현이 조절되며, 기계적 자극이 감소하면(예: 장기 부동) sclerostin 분비가 증가하여 뼈 손실이 촉진된다. Sclerostin 과다 발현은 골 형성 감소와 골밀도 저하를 유발하여 골다공증 위험을 높인다. 폐경 후 여성(에스트로겐 결핍)이나 글루코코르티코이드 과다 사용 환자에서 sclerostin 수준이 증가할 수 있으며, 이는 골 흡수 증가와 함께 뼈 손실을 가속화한다. 유전적으로 SOST 유전자 돌연변이(예: van Buchem 병)로 sclerostin이 결핍되면 뼈 과다 형성(high bone mass)이 나타나, sclerostin의 억제가 골다공증 치료의 표적이 됨을 시사한다.
Sclerostin 억제는 골다공증 치료에서 새로운 패러다임으로, 고위험 환자(예: T-score < -3.5, 다발 골절 병력)에서 골 형성을 촉진하는 데 유용하다.
Romosozumab (상품명: Evenity)은 골다공증 치료를 위한 인간화 단클론 항체로, sclerostin을 직접 억제하여 Wnt 경로를 활성화하고 뼈 형성을 촉진하며 골 흡수를 감소시키는 동화작용(anabolic) 약물이다. 폐경 후 여성 및 고위험 남성의 골절 위험 감소에 사용된다. FRAME 및 ARCH 시험에서 Romosozumab은 척추 및 비척추 골절 위험을 감소시키며, 특히 Abaloparatide나 Teriparatide와 순차적 사용 시 효과적이다.
그러나 Romosozumab 사용 시 심혈관 위험(예: 심근경색, 뇌졸중)이 보고되었으며, 이는 sclerostin 억제의 잠재적 부작용으로 주의가 필요하다.
골다공증 치료와 관리에서 보조제(supplements)는 뼈 건강을 지원하고 치료제(예: Romosozumab, Abaloparatide, Teriparatide, Raloxifene 등)의 효과를 극대화하는 데 중요한 역할을 한다.
| 골다공증 보조제 |
|---|
|
1. 칼슘 (Calcium): • 역할: - 뼈의 주요 구성 성분(골 기질의 99%가 칼슘)으로, 골밀도 유지와 뼈 형성에 필수적. - 칼슘 부족은 골 흡수를 증가시켜 골다공증 위험 증가. • 권장 섭취량 (미국 국립보건원, NIH 및 NOF 기준): 50세 이상 여성 및 70세 이상 남성: 1,200mg/일. 50세 이하 성인: 1,000mg/일. • 출처: - 식이: 유제품(우유, 치즈, 요거트), 녹색 잎 채소(케일, 브로콜리), 강화 식품(오렌지 주스, 시리얼). - 보조제: 칼슘 탄산염(carbonate, 식사와 함께 복용) 또는 칼슘 구연산염(citrate, 공복 복용 가능). ⚠️ 주의사항: • 과다 섭취(>2,000mg/일)는 신장 결석, 심혈관 위험(논란 중) 유발 가능. • 흡수율 향상을 위해 500-600mg 단위로 분할 복용. |
|
2. 비타민 D: • 역할: 장에서 칼슘 흡수를 촉진하고, 뼈 미네랄화를 지원. - 비타민 D 결핍은 골다공증과 골절 위험을 증가. • 권장 섭취량 (NIH 및 NOF 기준):50세 이상 성인: 800-1,000 IU/일 (일부는 2,000 IU 권장). - 혈중 25(OH)D 목표: ≥30 ng/mL. • 출처: - 식이: 지방이 많은 생선(연어, 고등어), 계란 노른자, 강화 우유. - 보조제: 비타민 D3(콜레칼시페롤)가 D2(에르고칼시페롤)보다 흡수율 우수. - 햇빛 노출: UVB를 통해 피부에서 합성. ⚠️ 주의사항: - 과다 섭취(>4,000 IU/일)는 고칼슘혈증, 신장 손상 위험. - 혈중 비타민 D 농도 모니터링 권장. |
|
3. 마그네슘 (Magnesium): • 역할: 뼈 미네랄화와 조골세포 활성에 기여. 칼슘과 비타민 D 대사 조절. • 권장 섭취량:여성: 310-320mg/일, 남성: 400-420mg/일. • 출처: - 식이: 견과류(아몬드), 씨앗, 통곡물, 녹색 채소. - 보조제: 마그네슘 옥사이드, 구연산마그네슘 등. ⚠️ 주의사항: - 과다 섭취 시 설사, 저혈압 발생 가능. |
|
4. 비타민 K: • 역할: 뼈 단백질(오스테오칼신)의 활성화를 통해 뼈 미네랄화를 지원. 골절 위험 감소에 기여 가능. • 권장 섭취량:여성: 90μg/일, 남성: 120μg/일 (비타민 K1/K2). • 출처: - 식이: 녹색 잎 채소(시금치, 케일), 발효 식품(natto, K2 제공). - 보조제: 비타민 K2(MK-7) 형태가 뼈 건강에 더 효과적일 수 있음. ⚠️ 주의사항: 와파린 같은 항응고제 복용자는 비타민 K 섭취 주의. 🔹 비타민 K2: • 비타민 K₂의 역할: - 비타민 K₂는 오스테오칼신(osteocalcin)과 같은 뼈 단백질의 γ-카르복실화(gamma-carboxylation)를 촉진하여 칼슘을 뼈 기질에 결합시키고 뼈 미네랄화를 강화. - 주요 형태는 메나퀴논-4(MK-4)와 메나퀴논-7(MK-7)으로, MK-7은 더 긴 반감기와 높은 생체 이용률을 나타냄. - 비타민 K₂는 골 흡수(파골세포 활동)를 억제하고 골 형성(조골세포 활동)을 촉진하여 골 전환 균형을 개선. • 일본 및 아시아 연구 중심으로, 비타민 K₂(MK-4, 45mg/일) 투여 시 요추 및 고관절 BMD 유지 또는 소폭 증가 보고. • Shiraki et al. (2000) 연구에서 MK-4 투여군은 위약군 대비 요추 BMD 감소 억제 및 척추 골절 위험 50% 감소. • 비타민 K₂는 척추 골절 위험을 약 60-77% 감소시켰으며, 비척추 골절(특히 고관절) 위험 감소 효과는 제한적. • 비타민 K₂는 칼슘 및 비타민 D와 함께 투여 시 시너지 효과를 보이며, BMD 개선과 골절 예방 효과가 강화. • 비스포스포네이트, Raloxifene, Teriparatide 등 약물과의 병용에서 뼈 건강 개선에 기여. • 고위험 환자(골절 병력, T-score < -2.5)에서 보조적 역할로 권장. • 투여 방법 및 권장량: - 형태: MK-4(45mg/일, 약물 형태로 일본에서 사용) 또는 MK-7(100-360μg/일, 보조제 형태). - 출처: 식이(낫토, 발효 식품, MK-7), 보조제(MK-4/MK-7). - 흡수: 지방과 함께 섭취 시 흡수율 증가. - 치료 기간: 장기 복용 안전, 1-3년 연구에서 효과 확인. ⚠️ 부작용 및 안전성: - 비타민 K₂는 일반적으로 안전하며, 심각한 부작용 보고가 드묾. ⚠️ 주의사항: - 와파린 같은 비타민 K 길항제(항응고제) 복용자는 혈액 응고에 영향을 미칠 수 있음. - 과다 섭취 시 독성 사례 없으나, 권장량 준수 권고. |
|
5. 오메가-3 지방산: • 역할: 항염증 효과로 뼈 흡수를 억제하고, 조골세포 활성을 촉진할 가능성. • 권장 섭취량: 명확한 권장량 없음, 일반적으로 250-500mg/일 (EPA+DHA). • 출처:식이: 고등어, 정어리, 연어, 치아씨드, 호두. • 보조제: 생선 오일 또는 조류 오일. ⚠️ 주의사항: 항응고제와 상호작용 가능. |
|
6. 단백질: • 역할: 뼈 기질(콜라겐)의 구성 요소로, 뼈 강도와 골 형성에 기여. • 권장 섭취량: 체중 1kg당 0.8-1.2g/일 (고령자는 1.0-1.2g 권장). • 출처: 살코기, 생선, 두부, 콩, 유제품, 보충제(유청 단백질). ⚠️ 주의사항: 신장 기능 저하 환자는 과다 섭취 주의. |
보조제는 식이 섭취가 부족할 때 보완적으로 사용하는 것이 좋으며, 균형 잡힌 식사가 최우선이다. 보조제 복용 전 혈액 검사(예: 25(OH)D, 칼슘 농도)를 통해 결핍 여부 확인하는 것을 권장하며, 약물(예: 비스포스포네이트, 항응고제)과의 상호작용에도 주의하여야 한다. 특히, 체중 부하 운동(걷기, 저항 훈련)과 금연, 절주가 보조제 효과를 강화하므로 생활습관을 조정하여야 한다.
비타민 K₂는 뼈 미네랄화와 골 형성 단백질 활성화에 기여하는 필수 영양소로, 골다공증 관리에서 보조적 역할을 할 수 있다.
비타민 K₂는 오스테오칼신(osteocalcin)과 같은 뼈 단백질의 γ-카르복실화(gamma-carboxylation)를 촉진하여 칼슘을 뼈 기질에 결합시키고 뼈 미네랄화를 강화한다. 주요 형태는 메나퀴논-4(MK-4)와 메나퀴논-7(MK-7)으로, MK-7은 더 긴 반감기와 생체 이용률을 가진다. 비타민 K₂는 골 흡수(파골세포 활동)를 억제하고 골 형성(조골세포 활동)을 촉진하여 골 전환 균형을 개선한다.
폐경 후 여성은 에스트로겐 결핍으로 인해 골 흡수가 증가하고 골밀도(BMD)가 감소한다. 비타민 K₂는 이 과정에서 뼈 손실을 완화하는 보조적 역할을 한다. 비타민 K₂ 결핍은 오스테오칼신의 비활성화(undercarboxylated osteocalcin, ucOC) 증가와 관련 있으며, 이는 골절 위험 증가와 연관된다. 비타민 K₂는 칼슘 및 비타민 D와 함께 투여 시 시너지 효과를 보이며, BMD 개선과 골절 예방 효과가 강화된다.
비타민 K₂는 오스테오칼신 활성화와 골 전환 균형을 통해 폐경 후 골다공증 관리에 유익하고, 척추 골절 예방에 효과적이며, 칼슘/비타민 D와 병용 시 더 큰 이점을 제공하지만 추가적인 대규모 RCT가 필요하며, 특히 서양 인구에서의 효능 확인이 요구된다.
한편, 운동은 BMD 개선, 근력/균형 강화, 낙상 위험 감소를 통해 골절 예방에 기여한다. 골다공증은 뼈 손실과 골절 위험 증가를 특징으로 하며, 근력 저하와 균형 장애로 낙상 위험이 높아지므로 약물(예: Romosozumab, Abaloparatide)과 운동을 병행 시 골 형성 및 뼈 건강 개선에 시너지 효과를 나타낸다.
체중 부하 및 저항 운동은 요추 및 고관절 BMD를 1-3% 증가시키며, 척추 골절 위험을 30-50% 감소시키는 것으로 나타났다. 또한 균형 운동은 낙상 발생률을 20-50% 줄이고, 고관절 골절 위험 감소에 기여하는 것으로 알려져 있다.
| 권장 운동 유형 |
|---|
1. 체중 부하 운동 (Weight-Bearing Exercise): • 목적: 뼈에 기계적 자극을 주어 BMD 유지/증가. • 예시: 빠르게 걷기, 조깅, 계단 오르기, 춤, 테니스. • 강도: 중간-높은 강도, 주 3-5회, 30-60분/세션. • 효과: 고관절 및 요추 BMD 개선, 특히 폐경 후 여성에서 유익. |
2. 저항 운동 (Resistance Exercise): • 목적: 근력과 근육량 증가, 골절 위험 감소. • 예시: 웨이트 트레이닝, 저항 밴드 운동, 체중 운동(스쿼트, 런지). • 강도: 8-12회 반복 가능한 중량, 주 2-3회. • 효과: 근골격계 강화, 낙상 예방. |
3. 균형 및 기능성 운동 (Balance and Functional Exercise): • 목적: 낙상 위험 감소, 자세 안정성 향상. • 예시: 태극권, 균형 보드, 단일 다리 서기, 요가. • 강도: 주 2-3회, 10-20분/세션. • 효과: 고령자에서 낙상 발생률 최대 50% 감소. |
4. 유연성 운동: 근육 유연성과 관절 가동성을 유지하여 낙상 방지. |
☑︎ 운동 프로그램 설계: • 개인화: 환자의 연령, 골밀도, 골절 병력, 체력 수준, 동반 질환(예: 관절염, 심혈관 질환)을 고려. • 진행성: 낮은 강도에서 시작해 점진적으로 강도/빈도 증가. • 안전성: 고위험 환자(골절 병력, 심한 골다공증)에서는 고충격 운동(점프, 달리기) 피하고 전문가 감독 하에 진행. • 병행 요법: 칼슘, 비타민 D, 비타민 K₂ 보충 및 약물 요법과 통합. • 모니터링: 물리치료사 또는 운동 전문가의 지도가 필요, 특히 고위험군. ⚠️ 위험: 척추 골절 병력이 있는 환자는 과도한 척추 굴곡/회전 운동 금지 (예: 윗몸일으키기, 골프 스윙). 🚫 금기: 심한 골다공증(T-score < -3.0) 또는 최근 골절 환자는 고충격 운동 금지. |
📚 References
Ganesan K, Goyal A, Roane D. Bisphosphonate. [Updated 2023 Jul 3]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Hildebrand GK, Patel P, Kasi A. Denosumab. [Updated 2024 Feb 28]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
International Osteoporosis Foundation(IOF). Treatment. 2025. https://www.osteoporosis. foundation /health-professionals /treatment
Anastasilakis AD, Toulis KA, Polyzos SA, Terpos E. RANKL inhibition for the management of patients with benign metabolic bone disorders. Expert Opin Investig Drugs. 2009 Aug;18(8):1085-102.
Cheng CH, Chen LR, Chen KH. Osteoporosis Due to Hormone Imbalance: An Overview of the Effects of Estrogen Deficiency and Glucocorticoid Overuse on Bone Turnover. Int J Mol Sci. 2022 Jan 25;23(3):1376.
Quintanilla Rodriguez BS, Correa R. Raloxifene. [Updated 2023 Feb 13]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Wooltorton E. Osteoporosis treatment: raloxifene (Evista) and stroke mortality. CMAJ. 2006 Jul 18;175(2):147.
Vall H, Patel P, Parmar M. Teriparatide. [Updated 2024 Feb 29]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Akel M, Patel P, Parmar M. Abaloparatide. [Updated 2024 Jan 29]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Krupa KN, Parmar M, Delo LF. Romosozumab. [Updated 2024 Jul 19]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Iwamoto J. Vitamin K₂ therapy for postmenopausal osteoporosis. Nutrients. 2014 May 16;6(5):1971-80.
Bae S, Lee S, Park H, Ju Y, Min SK, Cho J, Kim H, Ha YC, Rhee Y, Kim YP, Kim C. Position Statement: Exercise Guidelines for Osteoporosis Management and Fall Prevention in Osteoporosis Patients. J Bone Metab. 2023 May;30(2):149-165.